|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Біологія: Тематичне оцінювання №1 Повні уроки Тема
Мета уроку
Задачі уроку
Основні терміниКількість речовини – це кількість однакових частинок у речовині, які характеризують її як певну фізичну величину. Стала Авогадро - число структурних одиниць у молі будь-якої речовини. Молярна маса – маса одного моля даної речовини в грамах. Молярний об’єм газу – це відношення об’єму речовини до кількості цієї речовини. Відносна густина газів - це величина, яка характеризує, у скільки разів більша або нижча за відносну молекулярну маса одного газу відносна молекулярна маса другого газу. Прості речовини – це такі речовини, що утворюються атомами одного елемента. Складні речовини – які складаються за томів декількох різних елементів. Відносна молекулярна маса – величина, що дорівнює відношенню середньої маси молекули природного ізотопного складу речовини до маси атома. Хід урокуПеревірка засвоєного матеріалу з теми «Кількість речовини. Моль. Число Авогадро»З даного розділу ми вже знаємо що таке кількість речовини, що вимірюється вона в моль, і що для вимірювання застосовують число Авогадро. Щоб закріпити ці знання та згадати як виглядає число Авогадро, пропонуємо Вам подивитися наступне відео. Відео 1. Число Авогадро.
Розв’яжіть тестові завдання: 1. Хімічні речовини поділяються на: 2. Явище, коли багато простих елементів утворюють кілька простих речовин називають: 3. Число, яке показує кількість структурних одиниць у молі будь якої речовини називається: 4. За якої умови в ідентичних об’ємах різних газів буде міститися однакова кількість молекул? 5. Молярну масу можна обчислити для речовин у: Відповіді: Розв’яжіть кросворд, звертаючи увагу на картинки поруч із завданням. Мал. 1. Кросворд. 1. Електронейтральна частинка, що складається з позитивно зарядженого атомного ядра і негативно заряджених електронів. Мал. 2. Будова атома. 2. Речовина, середня молярна маса якої складає 29 г/моль і відносно якої найчастіше визначають відносну густину газу. 3. Одиниця вимірювання кількості речовини. Мал. 3. Моль. 4. Питома маса. 5. Теплова енергія, витрачена (або виділена) під час утворення 1 моля речовини з простих речовин. 6. Речовина, середня молярна маса якої складає 2г/моль і відносно якої найчастіше визначають відносну густину газу. 7. Явище, коли багато простих елементів утворюють кілька простих речовин. 8. Хімічний елемент у періодичній таблиці, за яким визначається кількість структурних одиниць, яку містить один моль. Мал. 4. Карбон Відповіді. Головне слово: Авогадро.
Відповіді: 1. ні; Розв’яжіть задачі.
Перевірка засвоєного матеріалу з теми «Молярна маса. Обчислення за хімічною формулою молярної маси, маси і кількості речовини»Ви вже розрізняєте поняття молярної та молекулярної мас та вмієте розв’язувати задачі. Щоб нагадати та закріпити ваші знання пропонуємо вам подивитися наступне відео. Відео 2. Моль, молярна маса.
Оберіть які твердження є вірними (так або ні). 1. Із атомів одного елемента будуть складатися молекули, які являють собою просту речовину, а з різних елементів складну речовину. Відповіді: 1. ні; Розв’яжіть задачі. 1. Скільки молів міститься у 392 г сульфатної кислоти H2SO4? Перевірка засвоєного матеріалу з теми «Молярний об’єм газів та їх відносна густина. Їх обчислення»Мал. 5. Амедео Авогадро. Ви пам’ятаєте що без знання закону Авогадро ми не змогли визначити молярний об’єм та густину газів. Тому пропонуємо вам подивитися наступне відео, щоб закріпити знання цього закону. Відео 3. Закон Авогадро.
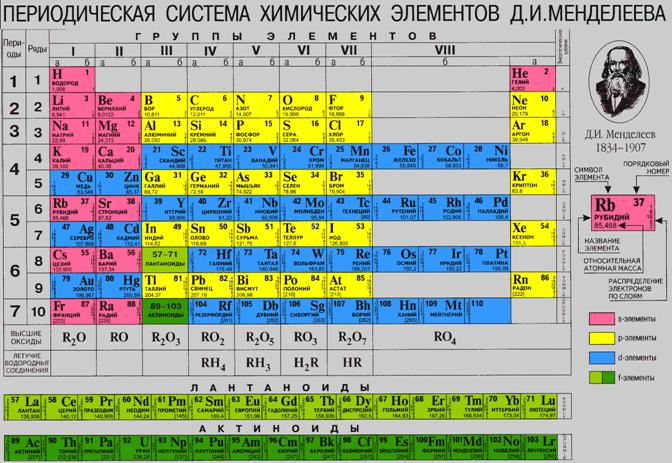
Оберіть які твердження є вірними (так або ні). 1. При однакових умовах гази, які реагують між собою, відносяться один до одного і до об’ємів газів, які утворилися, у вигляді невеликих цілих чисел. Відповіді: 1. ні; Розв’яжіть задачі ( для розв’язання використовуйте періодичну систему елементів). Мал.6. Періодична система хімічних елементів. 1. Обчисліть густину за воднем хлороводню HCl. Відповіді 3. N2H4 Цікаво знати, що…Дощ можна спостерігати не тільки в природних умовах. Явище дощу можна викликати в невеликому масштабі в лабораторії навіть у склянці. Для цього обережно прогрійте хімічний посуд (склянку), обертаючи її над полум’ям спиртівки, потім поставте її на азбестову сітку над нагрітою спиртівкою і налийте спирту. Коли спирт закипить, накрийте склянку фарфоровою чашкою або тарілкою з холодною водою, а ще краще зі снігом або льодом. Нагрівання припиніть. Пара спирту, скраплюючись, відразу ж утворює хмарку біля холодної поверхні посудини. Ця хмарка згодом заповнює посуд. На холодній частині посудини-охолоджувача (чашці, тарілці) пара спирту конденсується у краплинки, які починають падати на дно склянки: це падає «дощ». Список використаних джерел1. Урок на тему «Закон Авогадро. Молярний об’єм газу» Дорошенко О.В., вчителя хімії, м. Дніпропетровськ, сш №73.
Дорошенко О.В. Черчик Т.В. Лісняк А. В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: