|
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Простые вещества — неметаллы. Полные уроки
Тема. Простые вещества — неметаллы
Цели урока:
- создать условия для развития ключевых компетенций школьников через формирование полного представления о неметаллах, об их характерных отличиях от металлов.
Задачи урока:
- 1. Способствовать повторению и запоминанию важнейших понятий курса химии 8 класса для подготовки учащихся к естественному и быстрому усвоению нового материала.
- 2. Содействовать развитию учебно-познавательной, коммуникативной компетенций учащихся, через развитие логического мышления, памяти, речи учащихся, их умения выделять главное из общего, сравнивать и делать выводы.
- 3. Способствовать воспитанию в детях умения правильно строить ответы, работать у доски, умения вести диалог и работать в парах, фронтально и индивидуально, осуществлять адекватный выбор задания по своим возможностям в ситуации выбора.
Основные термины:
Неметаллы– химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
ХОД УРОКА
Простые вещества - неметаллы
Ученики, давайте с вами вместе рассмотрим таблицу Менделеева и разберем ее по металлам и неметаллам.
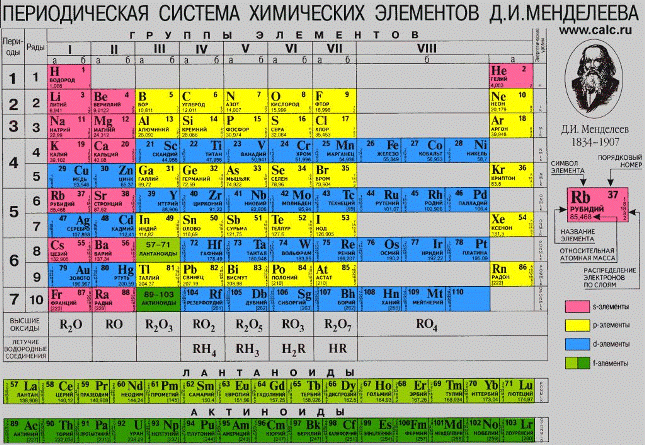
Рис. 1. Периодическая система Д.И. Менделеева
Неметаллы – химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
К неметаллам относятся инертные газы.
Каждая молекула инертного газа состоит из одного атома.
Покажите как распределяются электроны в атомах гелия и неона
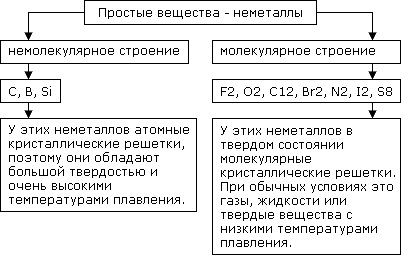
Рис. 2. Состав неметаллов
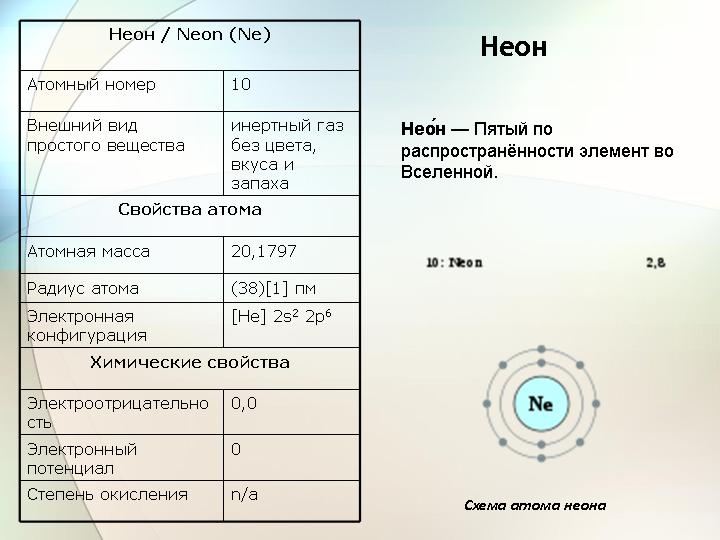
Рис. 3. Строение внешнего электронного слоя атомов гелия и неона
Посмотрите на рисунок 4. Где гелий применяется в природе?
Рис. 4. Применение гелия
А теперь давайте подумаем, где применяется неон и аргон?
Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями
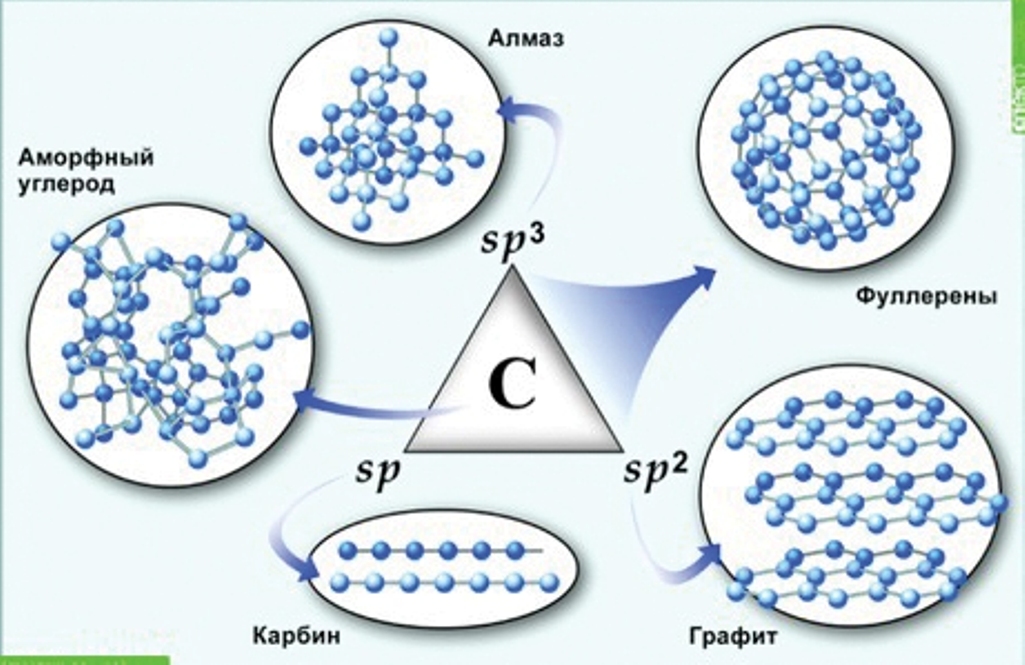
Рис. 5. Аллотропия углерода
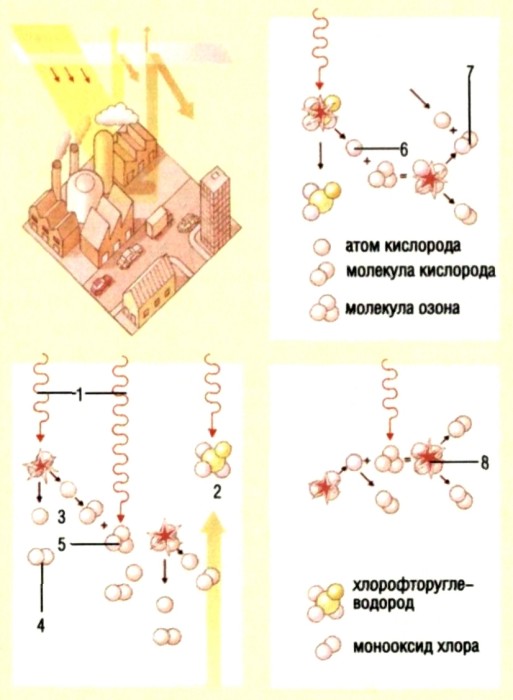
Рис. 6. Аллотропия кислорода
Составьте схемы строения электронной оболочки и схемы образования химической связи в следующих атомах и веществах:
• 1-я группа – атом углерода и молекула кислорода;
• 2-я группа – атом серы и молекула водорода;
• 3-я группа – атом фосфора и молекула хлора.
Группы работают в течение 5 минут.
После окончания работы и обсуждения записей делают общий вывод об особенностях строения атомов неметаллов и видах химической связи в молекулах простых веществ – неметаллов.
Интересно знать что ...
Кислород – самый распространенный химический элемент в земной коре. Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительное значение в жизни растений, животных и человека.
В 1772 г. шведский химик К.В. Шееле установил, что воздух состоит из кислорода и азота. В 1774 г. Д. Пристли получил кислород разложением оксида ртути (2). Кислород – бесцветный газ без вкуса и запаха, относительно мало растворим в воде, немного тяжелее воздуха: 1 л кислорода при нормальных условиях весит 1,43 г, а 1 л воздуха – 1,29 г. ( Нормальные условия – сокращенно: н. у. – температура 0 оС и давление 760 мм рт. ст., или 1 атм) . При давлении 760 мм рт. ст. и температуре – 183 оС кислород сжижается, а при снижении температуры до – 218,8 оС затвердевает.
Химический элемент кислород О, кроме обычного кислорода О2 , существует в виде еще одного простого вещества – озона О3. Кислород О2 превращается в озон в приборе, называемом озонатором.
Это газ с резким характерным запахом (название “озон” в переводе с греческого – “пахнущий”). Запах озона вы, вероятно, не раз ощущали во время грозы. Озон состоит из трех атомов элемента кислорода. Чистый озон – газ синего цвета, в полтора раза тяжелее кислорода, лучше его растворяется в воде.
В воздушной атмосфере над Землей на высоте 25 км существует озоновый слой. Там озон образуется из кислорода под воздействием ультрафиолетового излучения Солнца. В свою очередь озоновый слой задерживает это опасное для всех живых существ излучение, что обеспечивает нормальную жизнь на Земле.
Озон используют для обеззараживания питьевой воды, так как озон окисляет вредные примеси в природной воде. В медицине озон используют как дезинфицирующее средство.
1. Урок на тему «Простые вещества - неметаллы», учителя биологии и химии Яковлевой Ларисы Александровны, Курганская область, Петуховский райо, МОУ «Новогеоргиевская СОШ»
2. Ф. А. Деркач "Химия", - научно-методическое пособие. – Киев, 2008.
3. Л. Б. Цветкова «Неорганическая химия» – 2-е издание, исправленное и дополненное. – Львов, 2006.
4. В. В. Малиновский, П. Г. Нагорный «Неорганическая химия» - Киев, 2009.
4. Глинка Н.Л. Общая химия. – 27 изд./ Под. ред. В.А. Рабиновича. – Л.: Химия, 2008. – 704 с.ил.
Отредактировано и выслано Борисенко И.Н.
Над уроком работали:
Яковлева Л. А.
Борисенко И.Н.
Поставить вопрос о современном образовании, выразить идею или решить назревшую проблему Вы можете на Образовательном форуме, где на международном уровне собирается образовательный совет свежей мысли и действия. Создав блог, Вы не только повысите свой статус, как компетентного преподавателя, а и сделаете весомый вклад в развитие школы будущего. Гильдия Лидеров Образования открывает двери для специалистов высшего ранга и приглашает к сотрудничеству в направлении создания лучших в мире школ.
Предмети > Химия > Химия 8 класс
|