|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Кислород
Кислород является родоначальником главной подгруппы VI группы Периодической системы элементов. Элементы этой подгруппы — кислород О, сера S, селен Sе, теллур Те, полоний Ро — имеют общее название «халькогены», что означает «рождающие руды». Вспомните, с какими рудами, содержащими кислород и серу, вы уже познакомились.
С кислородом вы уже частично знакомились. Лабораторный способ получения кислорода вы освоили еще в прошлом году, знаете и способы его собирания и распознавания (вспомните их).
Вы теперь хорошо знакомы и с аллотропией кислорода, вам известно такое важное простое вещество, как озон. Сравните еще раз свойства кислорода O2 и озона О3, вспомните биологическое значение озона.
Кислород — самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает 2/3 поверхности земного шара, образуя его водную оболочку — гидросферу. Кислород — вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли — атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры — литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов (рис. 21).
Как вы уже знаете, обычный кислород существует в форме O2. Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом — синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксиды и пероксиды; с железом, образуя железную окалину Fе3O4; с алюминием, образуя оксид Аl2O3.

Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением — реакции горения. Вспомните горение серы с образованием S02, фосфора — с образованием Р2О5 или угля — с образованием С02.
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:
N2 + 02 <-> 2NO - Q
Кислород энергично окисляет не только простые, но и многие сложные вещества, при этом образуются оксиды элементов, из которых они построены:
СН4 + 202 = 2Н20 + С02
Метан
2H2S + 3O2 = 2SO2 + 2Н2O
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин — оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных.
Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Круговорот кислорода в природе иллюстрирует рисунок 22.
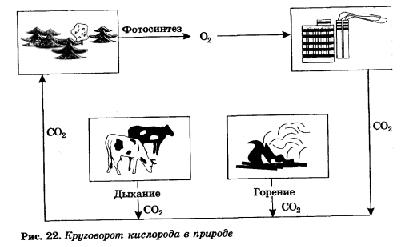
Повторим еще раз, что в промышленности кислород получают из жидкого воздуха, а в лаборатории путем разложения пероксида водорода Н202 в присутствии катализатора — диоксида марганца МnO2, а также разложением перманганата калия КМnO4 при нагревании.
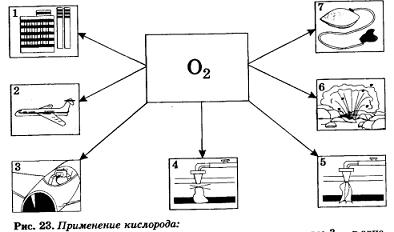
1 — в металлургии; 2 — как окислитель ракетного топлива; 3 — в авиации для дыхания; 4 — для резки металлов; 5 — для сварки металлов; 6 — при взрывных работах; 7 — в медицине (кислородная подушка)
Кислород применяют в металлургической и химической промышленности для ускорения (интенсификации) производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавильном производстве намного ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, например при газовой сварке и резке металлов.
Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями. Основные области применения кислорода представлены на рисунке 23.
Кислород хранят в стальных баллонах, окрашенных в голубой цвет, под давлением 150 атм. В лабораторных условиях кислород хранят в стеклянных приборах — газометрах.
Открытие кислорода. Кислород открыли и впервые получили почти одновременно два выдающихся химика второй половины XVIII в. — швед К. Шееле путем нагревания селитры и англичанин Д. Пристли при нагревании оксида ртути(II). Название этому элементу дал великий французский химик А. Лавуазье: oxygenium, т. е. «рождающий кислоты», или «кислород».
1. Кислород в природе — в атмосфере, литосфере, гидросфере.
2. Химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами.
3. Горение и медленное окисление.
4. Дыхание и фотосинтез.
5. Получение кислорода.
6. Применение кислорода.
Напишите уравнения реакций кислорода с металлами, о которых говорится в параграфе. Рассмотрите окислительно-восстановительные процессы.
Напишите уравнения реакций кислорода с неметаллами, о которых говорится в параграфе. Рассмотрите окислительно-восстановительные процессы.
Какие вещества называются катализаторами? Какая реакция, применяемая для получения кислорода, осуществляется в присутствии оксида марганца(IV)? Напишите уравнение этой реакции.
Английский химик Д. Пристли получил кислород разложением оксида ртути(II). Напишите уравнение этой реакции. Придумайте и решите задачу, в условии которой были бы указаны масса исходного вещества и доля в нем примесей, а требовалось бы найти объем кислорода при известном выходе его от теоретически возможного.
Укажите признаки сходства и различия в процессах дыхания и горения.
Сравните процессы дыхания и фотосинтеза.
Используя свои знания по химии кислорода, напишите сочинение на тему «Художественный образ вещества или процесса».
Напишите уравнение реакции фтора с водой. В какой роли здесь выступает кислород? Рассмотрите окислительно-восстановительный процесс, определите окислитель и восстановитель.
фишки для любознательных по химии, презентация урока 9 класса, учебники и учебные пособия для всех классов
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













