|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Соли''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Соли''' |
| | | | |
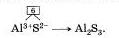
| - | <u>''Соли''</u> — зто сложные вещества, состоящие из ионов металлов и кислотных остатков.<br><br>Как видно из определения, соли по составу похожи на кислоты, только вместо ионов водорода они содержат ноны металла. Поэтому их можно также назвать продуктами замещения атомов водорода в кислоте на ионы металла. Например, всем известная поваренная соль КаСI может быть рассмотрена как продукт замещения водорода в соляной кислоте НСI на ион натрия. Ион натрия имеет заряд 1+, а ион хлора имеет заряд 1-. Так как соединение электроне йт рал ько, формула поваренной соли имеет вид Nа+С1-. Если же надо вывести формулу сульфида алюминия (III), поступают следующим образом. Обозначают заряды ионов, из которых состоит соединение: Аi3+S2-. Заряд иона алюминия 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты Н2S, он равен 2-. Затем находят наименьшее общее кратное числовых значений зарядов ионов алюминия и серы (3 и 2). оно равно 6. Зная это, можно найти индексы, разделив наименьшее общее кратное на величины зарядов, в записать следующую формулу:<br> | + | <u>''Соли''</u> — зто сложные вещества, состоящие из ионов металлов и кислотных остатков.<br><br>Как видно из определения, соли по составу похожи на [[Кислоты_органические_и_неорганические|кислоты]], только вместо ионов водорода они содержат ноны металла. Поэтому их можно также назвать продуктами замещения атомов водорода в кислоте на ионы металла. Например, всем известная поваренная соль КаСI может быть рассмотрена как продукт замещения водорода в соляной кислоте НСI на ион натрия. Ион натрия имеет заряд 1+, а ион хлора имеет заряд 1-. Так как соединение электроне йт рал ько, формула поваренной соли имеет вид Nа+С1-. Если же надо вывести формулу сульфида алюминия (III), поступают следующим образом. Обозначают заряды ионов, из которых состоит соединение: Аi3+S2-. Заряд иона алюминия 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты Н2S, он равен 2-. Затем находят наименьшее общее кратное числовых значений зарядов ионов алюминия и серы (3 и 2). оно равно 6. Зная это, можно найти индексы, разделив наименьшее общее кратное на величины зарядов, в записать следующую формулу:<br> |
| | | | |
| - | [[Image:him8-67.jpg]]<br> | + | [[Image:Him8-67.jpg|формула]]<br> |
| | | | |
| | + | <br> |
| | | | |
| | + | Аналогично поступают и для вывода формул солей кислородсодержащих кислот, имеющих сложные ионы. Выведем, например, формулу кальциевой соли фосфорной кислоты — фосфата кальция. По таблице [[Периодическая_система_химических_элементов_Д._И._Менделеева._Знаки_химических_элементов|Менделеева]] определим заряд иона кальция как элемента главной подгруппы II группы: 2+. По формуле фосфорной кислоты Н3РО4, определим заряд иона, образованного кислотным остатком: РО4 . Отсюда, формула фосфата кальция имеет вид: |
| | | | |
| - | Аналогично поступают и для вывода формул солей кислородсодержащих кислот, имеющих сложные ионы. Выведем, например, формулу кальциевой соли фосфорной кислоты — фосфата кальция. По таблице Менделеева определим заряд иона кальция как элемента главной подгруппы II группы: 2+. По формуле фосфорной кислоты Н3РО4, определим заряд иона, образованного кислотным остатком: РО4 . Отсюда, формула фосфата кальция имеет вид:
| + | [[Image:Him8-68.jpg|формула]]<br> |
| | | | |
| - | [[Image:him8-68.jpg]]<br>
| + | (Читается "кальций три пэ-о-четыре дважды")<br>Как образуются названия солей бескислородных кислот, вы уже рассмотрели. Соли HCl называются хлоридами, и соли H2S — сульфидами. |
| | | | |
| - | (Читается "кальций три пэ-о-четыре дважды")<br>Как образуются названия солей бескислородных кислот, вы уже рассмотрели. Соли HCl называются хлоридами, и соли H2S — сульфидами.
| + | <br>Названия солей кислородсодержащих кислот составляются из двух слов: названии иона, образованного кислотным остатком, в именительном падеже и названия нона [[Свойства_черных_и_цветных_металлов|металла]] — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, in корней название элементов, с суффиксами -am для высшей степени окисления и -um для низшей степени окисления атомов элемента-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты называются нитратами: KNO, нитрат калия, а соли азотистой кислоты HN02 - нитритами: — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: Fe2,SO2 - сульфит железа (II) и Fe- (SO,), сульфат железа (III). |
| | | | |
| - | <br>Названия солей кислородсодержащих кислот составляются из двух слов: названии иона, образованного кислотным остатком, в именительном падеже и названия нона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, in корней название элементов, с суффиксами -am для высшей степени окисления и -um для низшей степени окисления атомов элемента-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты называются нитратами: KNO, нитрат калия, а соли азотистой кислоты HN02 - нитритами: — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: Fe2,SO2 - сульфит железа (II) и Fe- (SO,), сульфат железа (III). | + | <br>Номенклатура солей приведена в таблице 5.<br> |
| | | | |
| - | <br>Номенклатура солей приведена в таблице 5.<br> | + | [[Image:Him8-69.jpg|соли]]<br> <br>По растворимости в воде соли делятся на растворимые (Р)б нерастворимые (Н) и малорастворнмые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если под рукой нет згой таблицы, можно воспользоваться приведенными ниже правилами. Их легко запомните. |
| | | | |
| - | [[Image:him8-69.jpg]]<br> <br>По растворимости в воде соли делятся на растворимые (Р)б нерастворимые (Н) и малорастворнмые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если под рукой нет згой таблицы, можно воспользоваться приведенными ниже правилами. Их легко запомните.
| + | <br>1. Растворимы все соли азотной кислоты — нитраты.<br>2. Рвстворимы все соля соля ной кислоты — хлориды, кроме AgCI(H). РbСl2,(М).<br>3. Растворимы все соли серной кислоты сульфаты, кроме BaSO4(H). PbSO4(H).<br>4. Растворимы соли натрия и калия.<br>5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и К+. |
| | | | |
| - | <br>1. Растворимы все соли азотной кислоты — нитраты.<br>2. Рвстворимы все соля соля ной кислоты — хлориды, кроме AgCI(H). РbСl2,(М).<br>3. Растворимы все соли серной кислоты сульфаты, кроме BaSO4(H). PbSO4(H).<br>4. Растворимы соли натрия и калия.<br>5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и К+. | + | <br>Рассмотрим растворимую натриевую соль бескислородной соляной кислоты — хлорид натрия NaCI, и нерастворимые кальциевые соли угольной и фосфорной кислот - карбонат кальция и фосфат кальция. |
| | | | |
| - | <br>Рассмотрим растворимую натриевую соль бескислородной соляной кислоты — хлорид натрия NaCI, и нерастворимые кальциевые соли угольной и фосфорной кислот - карбонат кальция и фосфат кальция. | + | <u>''<br>Хлорид натрия NaCI''</u> — хорошо растворимая н воде соль, известна под названием поваренная соль. Без втой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищн. Необходимость соли для жизни была известна со времен глубочайшей древности. Значение соли отражено в многочисленных [[Пословицы_и_поговорки|пословицах]], поговорках, обычаях. Хлеб да соль — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значение соли. Хлеб и соль стали символом гостеприимства и радушия русской нации. |
| | | | |
| - | <u>''<br>Хлорид натрия NaCI''</u> — хорошо растворимая н воде соль, известна под названием поваренная соль. Без втой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищн. Необходимость соли для жизни была известна со времен глубочайшей древности. Значение соли отражено в многочисленных пословицах, поговорках, обычаях. Хлеб да соль — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значение соли. Хлеб и соль стали символом гостеприимства и радушия русской нации.
| + | <br>Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5.5 кг соли. |
| | | | |
| - | <br>Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5.5 кг соли. | + | <br>В названиях многих городов и поселков разных стран присутствует слово соль: Соликамск, Соль-Илецк. Усолье, Усолье-Сибирское, Солт-Лейк-Сити. Солтвиль. Зальцбург и т. д. |
| | | | |
| - | <br>В названиях многих городов и поселков разных стран присутствует слово соль: Соликамск, Соль-Илецк. Усолье, Усолье-Сибирское, Солт-Лейк-Сити. Солтвиль. Зальцбург и т. д. | + | <br>Соль образует мощные отложения в земной коре. В Соль-Илецке, например, толщина пласта соли превышает полтора километра. Соли, находящейся в озере Баскунчак в Астраханской области, хватит нашей стране на 400 лет. Огромные количества соли содержат в себе воды морей и океанов. Солью можно было бы засыпать всю Сушу земного шара слоем в 130 м. |
| | | | |
| - | <br>Соль образует мощные отложения в земной коре. В Соль-Илецке, например, толщина пласта соли превышает полтора километра. Соли, находящейся в озере Баскунчак в Астраханской области, хватит нашей стране на 400 лет. Огромные количества соли содержат в себе воды морей и океанов. Солью можно было бы засыпать всю Сушу земного шара слоем в 130 м. | + | <br>Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в [[Нанотехнологии_в_медицине|медицине]], для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т. д. |
| | | | |
| - | <br>Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в медицине, для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т. д. | + | <br><u>''Карбонат кальция СаСО3''</u>, нерастворимый в воде, — важнейшая соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела — разнообразные по форме, многоцветные по окраске раковины. Скапливаясь после гибели своих хозяев на дне водоемов и главным образом морей, эти раковины за десятки и сотни миллионов лет образовали мощные пласты соединений кальция, давших начало образованию горных пород — известняков СаСО3. Эту же формулу имеет и замечательный строительный камень — мрамор, и столь привычный каждому школьнику, стоящему у доски, мел. Из известняка получают негашеную и гашеную известь, строят дома. Мрамор идет на изготовление статуй, мрамором отделаны станции московского метро. |
| | | | |
| - | <br><u>''Карбонат кальция СаСО3''</u>, нерастворимый в воде, — важнейшая соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела — разнообразные по форме, многоцветные по окраске раковины. Скапливаясь после гибели своих хозяев на дне водоемов и главным образом морей, эти раковины за десятки и сотни миллионов лет образовали мощные пласты соединений кальция, давших начало образованию горных пород — известняков СаСО3. Эту же формулу имеет и замечательный строительный камень — мрамор, и столь привычный каждому школьнику, стоящему у доски, мел. Из известняка получают негашеную и гашеную известь, строят дома. Мрамор идет на изготовление статуй, мрамором отделаны станции московского метро. | + | <br>Из этой соли наземные [[Забавные_животные|животные]] «строят» свои скелеты — внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры. |
| | | | |
| - | <br>Из этой соли наземные животные «строят» свои скелеты — внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры. | + | <u>''<br>Фосфат кальция Са(РО4)2''</u> нерастворим в воде — это основа минералов фосфоритов и апатитов. Из них производят необходимые в сельском хозяйстве фосфорные удобрения, без которых, в свою очередь, было бы невозможно получение высоких урожаев. Он входит в состав костей животных.<br> <br>1. Соли. 2. Номенклатуры солей. 3. Растворимые, нерастворимые и малорастворимые соли. 4. Хлорид натрия (поваренная голь). 5. Карбонат кальция (мел, мрамор, известняк) 6. Фосфат кальция. |
| | | | |
| - | <u>''<br>Фосфат кальция Са(РО4)2''</u> нерастворим в воде — это основа минералов фосфоритов и апатитов. Из них производят необходимые в сельском хозяйстве фосфорные удобрения, без которых, в свою очередь, было бы невозможно получение высоких урожаев. Он входит в состав костей животных.<br> <br>1. Соли. 2. Номенклатуры солей. 3. Растворимые, нерастворимые и малорастворимые соли. 4. Хлорид натрия (поваренная голь). 5. Карбонат кальция (мел, мрамор, известняк) 6. Фосфат кальция.
| + | <br>Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной (всего 9 формул). Дайте их названия. Какие из солей растворимы в воде? |
| | | | |
| - | <br>Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной (всего 9 формул). Дайте их названия. Какие из солей растворимы в воде? | + | <br>Запишите формулы следующих солей: а) карбоната калия, сульфида свинца (II), нитрата железа (Ш); б) хлорида свинца (IV). фосфата натрия, нитрата алюминия. |
| | | | |
| - | <br>Запишите формулы следующих солей: а) карбоната калия, сульфида свинца (II), нитрата железа (Ш); б) хлорида свинца (IV). фосфата натрия, нитрата алюминия.
| + | <br>Из перечисленных формул H2S, K2SO3, КОН, S03, Fe(OH)3, FeO, N202, Сu3(РО4)2, Cu20, Р2О5, H3PO4 выпишите последовательно формулы: а) [[Оксиды,_их_классификация_и_свойства|оксидов]], б) кислот, в) оснований, г) солей. Дайте названия веществ.<br><br> <sub>задания по [[Химия|химии]], креативные задания для [[Химия 8 класс|8 класса]], [[Гипермаркет знаний - первый в мире!|шпаргалки]] для 8 класса </sub> |
| - | | + | |
| - | <br>Из перечисленных формул H2S, K2SO3, КОН, S03, Fe(OH)3, FeO, N202, Сu3(РО4)2, Cu20, Р2О5, H3PO4 выпишите последовательно формулы: а) оксидов, б) кислот, в) оснований, г) солей. Дайте названия веществ.<br><br> <sub>задания по [[Химия|химии]], креативные задания для [[Химия_8_класс|8 класса]], [[Гипермаркет_знаний_-_первый_в_мире!|шпаргалки]] для 8 класса </sub> | + | |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Версия 04:50, 29 июня 2012
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Соли
Соли — зто сложные вещества, состоящие из ионов металлов и кислотных остатков.
Как видно из определения, соли по составу похожи на кислоты, только вместо ионов водорода они содержат ноны металла. Поэтому их можно также назвать продуктами замещения атомов водорода в кислоте на ионы металла. Например, всем известная поваренная соль КаСI может быть рассмотрена как продукт замещения водорода в соляной кислоте НСI на ион натрия. Ион натрия имеет заряд 1+, а ион хлора имеет заряд 1-. Так как соединение электроне йт рал ько, формула поваренной соли имеет вид Nа+С1-. Если же надо вывести формулу сульфида алюминия (III), поступают следующим образом. Обозначают заряды ионов, из которых состоит соединение: Аi3+S2-. Заряд иона алюминия 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты Н2S, он равен 2-. Затем находят наименьшее общее кратное числовых значений зарядов ионов алюминия и серы (3 и 2). оно равно 6. Зная это, можно найти индексы, разделив наименьшее общее кратное на величины зарядов, в записать следующую формулу:
Аналогично поступают и для вывода формул солей кислородсодержащих кислот, имеющих сложные ионы. Выведем, например, формулу кальциевой соли фосфорной кислоты — фосфата кальция. По таблице Менделеева определим заряд иона кальция как элемента главной подгруппы II группы: 2+. По формуле фосфорной кислоты Н3РО4, определим заряд иона, образованного кислотным остатком: РО4 . Отсюда, формула фосфата кальция имеет вид:
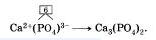
(Читается "кальций три пэ-о-четыре дважды")
Как образуются названия солей бескислородных кислот, вы уже рассмотрели. Соли HCl называются хлоридами, и соли H2S — сульфидами.
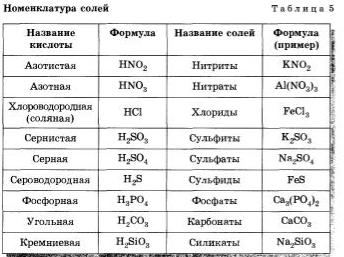
Названия солей кислородсодержащих кислот составляются из двух слов: названии иона, образованного кислотным остатком, в именительном падеже и названия нона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, in корней название элементов, с суффиксами -am для высшей степени окисления и -um для низшей степени окисления атомов элемента-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты называются нитратами: KNO, нитрат калия, а соли азотистой кислоты HN02 - нитритами: — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: Fe2,SO2 - сульфит железа (II) и Fe- (SO,), сульфат железа (III).
Номенклатура солей приведена в таблице 5.
По растворимости в воде соли делятся на растворимые (Р)б нерастворимые (Н) и малорастворнмые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если под рукой нет згой таблицы, можно воспользоваться приведенными ниже правилами. Их легко запомните.
1. Растворимы все соли азотной кислоты — нитраты.
2. Рвстворимы все соля соля ной кислоты — хлориды, кроме AgCI(H). РbСl2,(М).
3. Растворимы все соли серной кислоты сульфаты, кроме BaSO4(H). PbSO4(H).
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и К+.
Рассмотрим растворимую натриевую соль бескислородной соляной кислоты — хлорид натрия NaCI, и нерастворимые кальциевые соли угольной и фосфорной кислот - карбонат кальция и фосфат кальция.
Хлорид натрия NaCI — хорошо растворимая н воде соль, известна под названием поваренная соль. Без втой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищн. Необходимость соли для жизни была известна со времен глубочайшей древности. Значение соли отражено в многочисленных пословицах, поговорках, обычаях. Хлеб да соль — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значение соли. Хлеб и соль стали символом гостеприимства и радушия русской нации.
Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5.5 кг соли.
В названиях многих городов и поселков разных стран присутствует слово соль: Соликамск, Соль-Илецк. Усолье, Усолье-Сибирское, Солт-Лейк-Сити. Солтвиль. Зальцбург и т. д.
Соль образует мощные отложения в земной коре. В Соль-Илецке, например, толщина пласта соли превышает полтора километра. Соли, находящейся в озере Баскунчак в Астраханской области, хватит нашей стране на 400 лет. Огромные количества соли содержат в себе воды морей и океанов. Солью можно было бы засыпать всю Сушу земного шара слоем в 130 м.
Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в медицине, для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т. д.
Карбонат кальция СаСО3, нерастворимый в воде, — важнейшая соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела — разнообразные по форме, многоцветные по окраске раковины. Скапливаясь после гибели своих хозяев на дне водоемов и главным образом морей, эти раковины за десятки и сотни миллионов лет образовали мощные пласты соединений кальция, давших начало образованию горных пород — известняков СаСО3. Эту же формулу имеет и замечательный строительный камень — мрамор, и столь привычный каждому школьнику, стоящему у доски, мел. Из известняка получают негашеную и гашеную известь, строят дома. Мрамор идет на изготовление статуй, мрамором отделаны станции московского метро.
Из этой соли наземные животные «строят» свои скелеты — внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры.
Фосфат кальция Са(РО4)2 нерастворим в воде — это основа минералов фосфоритов и апатитов. Из них производят необходимые в сельском хозяйстве фосфорные удобрения, без которых, в свою очередь, было бы невозможно получение высоких урожаев. Он входит в состав костей животных.
1. Соли. 2. Номенклатуры солей. 3. Растворимые, нерастворимые и малорастворимые соли. 4. Хлорид натрия (поваренная голь). 5. Карбонат кальция (мел, мрамор, известняк) 6. Фосфат кальция.
Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной (всего 9 формул). Дайте их названия. Какие из солей растворимы в воде?
Запишите формулы следующих солей: а) карбоната калия, сульфида свинца (II), нитрата железа (Ш); б) хлорида свинца (IV). фосфата натрия, нитрата алюминия.
Из перечисленных формул H2S, K2SO3, КОН, S03, Fe(OH)3, FeO, N202, Сu3(РО4)2, Cu20, Р2О5, H3PO4 выпишите последовательно формулы: а) оксидов, б) кислот, в) оснований, г) солей. Дайте названия веществ.
задания по химии, креативные задания для 8 класса, шпаргалки для 8 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











