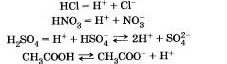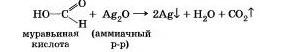|
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Кислоты органические и неорганические
Вы уже знаете немало определений кислот как класса сложных веществ.
Кислотами называют сложные вещества, которые состоят из атомов водорода, способных замещаться на металл, и кислотного остатка.
В свете теории электролитической диссоциации к кислотам относят электролиты, которые при диссоциации образуют катионы только одного типа — гидратированные ионы водорода.
Теория электролитической диссоциации объясняет кислотно-основные свойства водных растворов электролитов присутствием в них избытка ионов.
Наряду с этим известны реакции, в которых вещества взаимодействуют как кислота и основание при отсутствии в них ионов водорода и гидроксид-ионов. Вспомните, например, образование хлорида аммония при взаимодействии газообразных хлороводорода и аммиака, известное вам как дым без огня.
В 1923 г. появилась протолитическая теория кислот и оснований Брёнстеда—Лаур и, которая расширила представления о кислотах и основаниях, объяснила поведение веществ в водных и неводных (спиртовых, эфирных, аммиачиых) растворах. Согласно этой теории кислоты — это молекулы или ионы, которые являются в данной реакции донорами катионов водорода Н+ то есть отдают их.
Соответственно снования — это молекулы или ионы, которые прини мают катионы Н+, то есть являются акцепторами Н+.
С точки зрения этой теории распад электролита на ионы (I) и гидролиз по аниону (2) рассматривают как кислотно-основное взаимодействие электролитов и воды.
В реакции (1) Н20 ведет себя как основание — присоединяет протон (Н+) и образует ион оксония по донорно-акцепторному механизму.
Теперь, когда вы познакомились с более широким взглядом на ирнроду кислотно-основных свойств химических соединений, сделаем обобщение сведений о классе кислот, рассмотрев классификацию и свойства неорганических и органических кислот (табл. 17).
Свойства кислот
Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
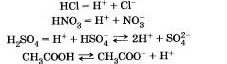

Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимые соли.
4. И те и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовать как средние, так и кислые соли (это реакции нейтрализации)
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ.
6. Сложные эфиры образуют не только органические кислоты согласно общему уравнению.
Аналогичная реакция с ушетием двух и трех гидроксо-групп целлюлозы при ее нитровании приводит к получению сложных зфиров: ли- и тринитроцеллюлозы — очень необходимых веществ для производства бездымного пороха.
Вместе с тем отдельные представители минеральных и органических кислот имеют и особые свойства.
Уксусная кислота СН3СО0Н, как и другие карбоновые кислоты, содержит в молекуле углеводородный радикал. В нем возможны реакции замещения водорода галогенами:
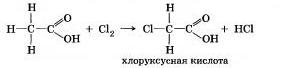
Под влиянием атомов галогена в молекуле кислоты ее степень диссоциации сильно повышается. Например, хлоруксус-няя кислота почти в 100 раз сильнее уксусной (почему?).
Муравьиная кислота НСООН. в отлмчие от уксусной, не имеет в молекуле углеводородного радикала. Вместо него она содержит атом водорода, а потому является веществом с двойственной функцией — альдегидокислотой и. в отличие от других карбоновых кислот, дает реакцию «серебряного зеркала». Образующаяся угольная кислота Н2С03 распадается на воду и углекислый газ.
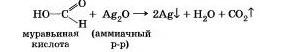
1. Как природа кислоты влияет на степень электролитическойдиссоциации? Рассмотрите это влияние на примерах: а) азотной и азотистой кислот, б) хлорноватистой НСlO и хлорной НСl04. d) сернистой и серной кислот. Сделайте общий вывод.
2. Рассмотрите взаимное влияние атомов в молекуле пропп-пновой кислоты СН3—СН2—СООН по плану: а) влияние радикала на карбоксил; б) влияние карбоксила на радикал; в) влияние карбоннла на гидрокенл; г) влияние гидроксила на карбонил.
3. Расположите хлорпронзводные уксусной кислоты в порядке увеличения их силы. Объясните ответ.
4. Почету азотная и серная (конц.) кислоты ведут себя в реакциях с металлами иначе, чем, например, соляная?
8. В 730 г 12%-ной соляной кислоты растворили 33.б л хлороводородов. Найдите массовую долю хлороподорода в полученном растворе.
Ответ: 18.14%.
9. В 820 г 0.5%-ного раствора сернистой кислоты растворили еще 11.2л сернистого газа. Какой стала массовая доля кислоты в полученном растворе?
Ответ: 5.29%.
обновление фрагмента в учебнике химии, домашнее задание по химии 11 класса, аудио к урокам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|