|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры
В предыдущем параграфе мы уже отмечали, что скорость химических реакций зависит от природы реагирующих веществ. В качестве примера можно привести реакций окисления серебра кислородом и озоном: первая идет медленно, вторая протекает почти мгновенно.
Проделаем двн опыта, показывающие влияние природы реагирующих веществ на скорость химической реакции. Нальем я три пробирки по 2 мл раствора соляной кислоты и опустим в первую пробирку гранулу цинка, во вторую - кусочек магния, в третью - кусочек железа. Постараемся, чтобы количество металлов и площадь их поверхности были приблизительно одинаковыми. В результате наблюдений можно заметить, что с наибольшей скоростью реагирует с кислотой магний, потом цинк и медленнее всего — железо. На скорость химической реакции оказывает влияние природе металла. А влияет ли на скорость реакции аналогично и ирнрола второго реагента — кислоты? Проделаем второй опыт. Опустим в лвс пробирки по одной грануле цинка и прильем в первую — 2 мл уксусной кислоты, а во вторую — 2 мл соляной кислоты одинаковой молярной концентрации. Нетрудно заметить, что скорость реак ни и взаимодействия цинка с соляной кислотой выше, чем скорость взаимодействия цинка с уксусной кислотой.
Влияние природы веществ на скорость химических реакций очень велико. Например, процесс превращения гранита в глину, тек называемое выветривание горных пород, протекает на протяжении тысячелетий. Природа бутылочного или оконного стекла, полиэтилена и других веществ, созданных человеком, такова, что эти вещества практически не разлагаются или разлагаются чрезвычайно медленно. Вот и приходится человеку находить способы их утилизации, например сжигать. И как мудро распорядилась эволюция, когда предусмотрела для человека и большинства животных в качестве транспортирующего кислород вещества гемоглобин крови, который уже при комнатной температуре способен соединяться с кислородом воздуха со значительной скоростью, а следовательно, и быстро доставлять его из легких в тканях.
Слелующим важнейшим фактором, влияющим на скорость химической реакции, является концентрация {содержание) реагирующих веществ.
Проделаем опыт, показывающий это влияние. Нальем в три пробирки раствор тиосульфата натрия, который ребятам, занимающимся фотографией, известен иод названием фиксажа. В первую пробирку — 3 мл. во вторую — 2 мл и в третью — 1 мл. Затем прильем во все пробирки воды так, чтобы уровень растворов тиосульфата в них стал одинаковым — 5 мл. то есть в первую пробирку прильем 2 мл воды, во вторую — 3 мл. а в третью — 4 мл.
Понятно, что наибольшей будет концентрация раствора тиосульфата н первой пробирке, а наименьшей — в третьей. Теперь быстро прильем в каждую пробирку (начиная с третьей) по 2 мл раствора серной кислоты и проследим, в какой из них раньше всего выпадет осадок серы. Раньше всего он образуется там. где выше концентрация тиосульфата, то есть в первой пробирке. Это и понятно. Ведь для химического взаимодействия серной кислоты и тиосульфата необходимо, чтобы частички (ионы), из которых они состоят, столкнулись. Чем больше число столкновений, тем быстрее протекает реакция. А число столкновений тем больше, чем больше концентрация реагирующих веществ, то есть количества, или массы, этих веществ в единице объема.
На основании обширного экспериментального материала в 1867 г. норвежские ученые К. Гульдберг и П. Вааге сформулировали основной лакан химической кинетики, который устанавливал зависимость скорости химической реакции от концентрации реагирующих веществ.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам.
Скорость простой (злементарной), протекающей в одну стадию реакции и записанной в общей форме
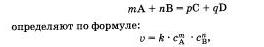
где v — скорость реакции, C A — молярная концентрация вещества А, C B — молярная концентрация вещества В, m n их коэффициенты, а k — константа, которая равна скорости реакции при концентрации реагирующих веществ 1 моль/л (справочная величина).
Этот закон называют также законом действующих масс. Он не распространяется на вещества, находящиеся в твердом состоянии, так как считается, что их концентрация постоянна, нескольку они реагируют лишь на поверхности, которая, как считается, остается практически неизменной (гетерогенная реакция).
Например, рассмотрим реакцию взаимодействия меди с кислородом:
2Сu + О2 = 2СuО.
Скорость этой реакции пропорциональна концентрации кислорода, так как соударения можду молекулами кислорода и меди могут происходить только на поверхности раздела веществ, а значит, масса меди не влияет на скорость реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант Гоффе (1884):
При повышении температуры на каждые 10° С скорость реакции увеличивается в 2—1 раза.
Впервые в истории науки Вант-Гоффу была вручена Нобелевская прения по химии.
Взаимнодействие водорода и кислороде при комнатной температуре почти не происходит - так мала скорость реакции. При 500 °С эта реакция протекает всего эа 50 мин. а при 700 °С она происходит почти мгновенно:
H2+O2 = 2H2O
Математически правило Вант-Гоффа записывается следующей формулой:
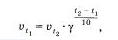
Правило ВантГоффа является приближенным и применяется лишь для ориентировочной оценки влияния температуры на скорость реакции. Згу зависимость также легко проверить опытным путем. Нальем н три химических стаканчика одинаковые объемы раствора тиосульфата натрия. Одинаковые растворы серной кислоты, которые мы одновременно будем приливать в эти стаканчики ні трех пробирок, нагреем до разных температур: в первой пробирке оставим раствор комнатной температуры: вторую пробирку нагреем до 40 °С. а третью -до 70 °С. Нетрудно заметить, что вначале помутнеет раствор тиосульфата, к которому прилили самый горячий раствор кислоты, потом — теплый в. наконец. — раствор тиосульфата натрии, к которому придали раствор серной кислоты комнатной температуры.
Итак, мы выяснили, что скорость химической реакции зависит от следующих факторов: от природы реагирующих веществ, концентрации, температуры, площади соприкосновения реагирующих веществ (для гетерогенных реакций). Зависимость скорости реакций еще от одного важнейшего фактора — от катализатора мы рассмотрим в следующем параграфе.
1. Зависимость скорости химической реакции от природы реагирующих веществ. 2. Зависимость скорости химической реакции от концентрации реагирующих веществ — основной закон химической кинетики (закон действующих масс), 3. Зависимость скорости химической реакции от температуры — правило Ваит-Гоффа.
Почему горение веществ (серы. угля, фосфора, железа) в чистом кислороде происходит гораздо энергичнее, чем на воздухе?
Чем отличаются процессы дыхания и гниения, известные вам из курса биологии, от процессов горения? Почему?
Запишите уравнение реакции взаимодействия магния и соляной кислоты. Придумайте на это уравнение задачу, в которой была бы известна масса магния с определен нон массовой долей прпмесей, а требовалось бы найти объем водорода. Решите ее.
Решите задачу, в которой была бы дана масса раствора исходного вещества, содержащая определенную массовую долю его, для реакции взаимодействия гидроксида натрия и серной кислоты.
Для реакции были взяты вещества при температуре 40 "С. затем их нагрели до 70 Как изменится скорость химической реакции, вели температурный коэффициент ее равен 27
Запишите уравнения, отражающие закон действия масс для элементарных реакций:
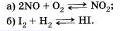
Почему продукты питания хранят в холодильниках, то есть при низких температурах?
видеоклипы к уроку химии, химия для 8 класса, конспекты уроков
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|










