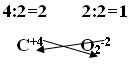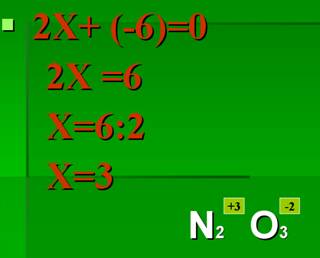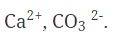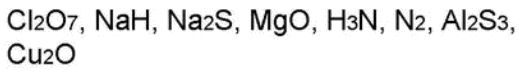|
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Степень окисления. Полные уроки
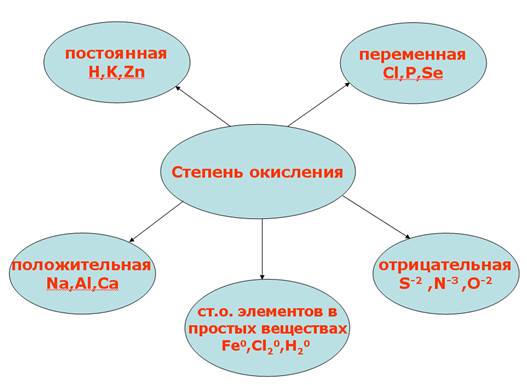
Цели урока
Задачи урока• обучающие: продолжить изучение валентности, узнать, что такое степень окисления, рассмотреть ее виды, а также научиться правильно определять степени окисления атома в соединении; • развивающие: научить приемам обобщения и сравнения, развить навыки самостоятельной работы, способствовать развитию логического мышления; • воспитательные: сформировать чувство толерантности. Основные термины
Проверка домашнего задания1. В каких молекулах существует неполярная ковалентная связь? • А) J2 • Б)СО2 • В) О2 • Г) Н2О • Д) К2О 2)У какой молекулы при образовании ковалентно - неполярной связи образуется тройная связь? • А) СI2 • Б)N2 • В)О2 • Г)S2 3)Как называется положительно заряженные ионы? • А) катионы • Б)молекулы • В)анионы • Г) кристаллы 4)В каком ряду располагаются вещества ионного соединения? • А)СН4, NН3, Мg • Б)СI2, МgО, NаСI • В) МgF2, NаСI, СаСI2 • Г)Н2S, НСI, Н2О 5)Валентность определяются по: • А)по номеру группы • Б)по числу неспаренных электронов • В)по типу химической связи • Г) по номеру периода.
Степень окисленияСначала давайте вспомним, что такое валентность:
Степень окисления у молекул с различными химическими связями образуется следующим образом: 1. В соединениях с ионной связью степени окисления элементов равно зарядам ионов. Пример этого можно посмотреть на рисунке 1. Рис.1. Иллюстрация степени окисления элементов в соединениях с ионной связью. 2. В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0. Н20, СI20, F20, S0, AI0 3. Степень окисления у молекул с ковалентно-полярной связью определяется подобно молекулам с ионной химической связью. Степень окисления элемента – это условный заряд его атома, в молекуле, если считать, что молекула состоит из ионов. Степень окисления атома в отличие от валентности имеет знак. Она может быть положительной, отрицательной и нулевой. На рисунке 2 представлены виды степени окисления. Рис. 2. Степени окисления. Валентность обозначатся римскими цифрами сверху символа элемента, а степень окисления обозначается арабскими цифрами с зарядом над символом элемента (рисунок 3). Рис. 3. Обозначение валентности и степени окисления. У одного и того же элемента могут быть разные степени окисления. Так, на рисунке 4 представлены степени окисления серы. Рис. 4. Степени окисления серы. Теперь давайте посмотрим на определение степени окисления оксидов:
Положительная степень окисления равна числу электронов, которые отданы данным атомом. Атом может отдать все валентные электрон, соответствующие номеру группы, в котором элемент находится, при этом проявляя высшую степень окисления (исключение ОF2). Отрицательная степень окисления равна числу электронов, которые приняты данным атомом (проявляется только у неметаллов). Атомы неметаллов присоединяют то количество электронов, которое им до завершения внешнего уровня не достает, при этом проявляя отрицательную степень. На рисунке 5 представлены примеры высших и низших степеней окисления. Рис. 5. Высшие и низшие степени окисления. Значение степени окисления между высшим и низшим степенями окислений называется промежуточными (рисунок 6): Рис. 6. Промежуточная степень окисления. В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0: Н20, СI20, F20, S0, AI0 Для определения степени окисления атома в соединении следует учитывать ряд положений (рисунок 7). Рис. 7. Положения, которые следует учитывать для определения степени окисления атома в соединении. Очень скоро вы познакомитесь с окислительно-восстановительными реакциями:
Составление формулы веществаСуществует несколько способов составления формул вещества по степени окисления, однако сначала запомните алгоритм и правило их составления (рисунок 8): Рис.8. Алгоритм составления химических формул по степени окисления. Давайте посмотрим, как составлять формулы оксидов:
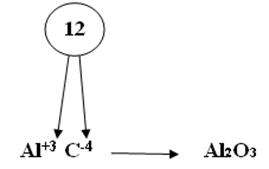
Первый способ составления формул:1. На первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью. 2. Элемент, написанный на первом месте имеет положительный заряд «+», а на втором с отрицательным зарядом «-». 3. Указать для каждого элемента степень окисления. 4. Найти общее кратное значение степеней окисления. 5. Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента. На рисунке 9 представлен пример этого пункта: Рис. 9. Пример пункта 5 составления формул. 6. Если степень окисления четное – нечетное, то они становятся рядом с символом справа внизу крест – накрест без знака «+» и «-». Пример того, как оформлять этот пункт, представлен на рисунке 10. Рис. 10. Пример пункта 6 составления формул. 7. Если степень окисления имеет четное значение, то их сначала нужно сократить на наименьшее значение степени окисления и поставить крест – накрест без знака «+» и «-»: С+4 О-2. Пример того, как оформлять такое соединений, представлен на рисунке 11. Рис. 11. Пример пункта 7 составления формул. Второй способ составления формул:1. Обозначим степень окисления N через Х, указать степень окисления О: N2x O3-2 2. Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода: 3• (-2)= -6 3.Чтобы молекула была электронейтральной нужно определить сумму положительных зарядов: Х2 = 2Х 4.Составить алгебраическое уравнение (рисунок 12). Рис.12. Составление алгебраического уравнения.
Выводы
1. Степень окисления —условный заряд атомов химического элемента в соединении, который вычислен на основе предположения, что все соединения состоят только из ионов. 2. У степени окисления может быть положительное, отрицательное или нулевое значения, которые ставятся обычно над символом элемента сверху. 3. Положительная степень окисления равна числу электронов, которые отданы данным атомом. 4. Отрицательная степень окисления равна числу электронов, которые приняты данным атомом (проявляется только у неметаллов).
Контролирующий блок
1. Что такое степень окисления? 2. Какие есть виды степеней окисления? 3. Что такое промежуточная степень окисления? 4. Как составить формулу в соединениях?
Домашнее задание
Дайте названия следующих бинарных соединений: Cl2O7, Cl2O, ClO2, FeCl2, FeCl3, MnS, MnO2, MnO, MnCl4, Cu2O, Mg2Si, Na3N, FeS. Написать формулы веществ состоящих из следующих элементов: 1. Р и О 2. N и H 3. Zn и Cl
Правила определения степени окисленияНа этом уроке мы с вами познакомились с такой темой, как степень окисления. Давайте с вами подытожим и вспомним, и еще раз вспомним определение степени окисления. Мы с вами уже знаем, что степенью окисления называют такой условный и вспомогательный заряд атомов химического элемента в соединении, который вычисляется из такого предложения, в котором все ионные и ковалентно - полярные соединения состоят только из ионов. Суждение о степени окисления различных элементов могут быть полезны: • во-первых, при компоновке классификации химических веществ; Как правило, степень окисления атомов в веществах со сложным строением вначале обозначаются знаком, затем цифрой. Обозначение цифр может быть такой: +1, +2, -2 и другими. Если гипотетически представить, что в соединении существует заряд иона, то в этом случае следует вначале указывать цифру, а потом уже знак. Приведем пример: Но для нахождения степени окисления существуют определенные правила. Давайте более подробно остановимся на этих правилах. И так при определении степени окисления атомов необходимо придерживаться следующих правил: • Во-первых, в простых веществах степень окисления атомов равняется нулю; • Во-вторых, алгебраическая сумма степеней окисления в нейтральных молекулах также равна нулю. А вот для ионов алгебраическая сумма равняется заряду иона. • В-третьих, практически во всех соединениях водород имеет степень окисления, которая равняется +1, за исключением гидридов активных металлов. В них СО будет равняться -1. • В-четвертых, если рассматривать атомы кислорода, то в его соединениях СО = -2. В этом случае исключением являются OF2 и пероксиды металлов и соответственно в этом случае СО кислорода будет равно +2 и -1. • Следующим правилом будет СО щелочных металлов. Если брать элементы первой группы из главной подгруппы, то СО = +1. А вот элементы второй группы, к которым относятся щелочно-земельные металлы в соединении имеют степень окисления равную +2. Для алюминия СО = +3, а для фтора = -1. • Если рассматривать ковалентные соединения, то в нем более электроотрицательный атом всегда показывает степень окисления со знаком «-». А вот в соединениях с менее электроотрицательным атомом СО имеет знак «+». • Если же рассматривать простые ионные соединения, то их степень окисления будет равна и по величине и по тому знаку, который имеет его электрический заряд. А теперь более подробно рассмотрим правила для промежуточных степеней окисления: Но следует отметить, что всех этих правил следует придерживаться в том случае, если мы имеем дело с постоянной степенью окисления. В случае же, когда в химических элементах СО переменная, то она, как правило, зависит от порядка, а также от типов атомов в этом соединении. Практическое задание1. Вам даны формулы химических элементов. Определите степень окисления по этим формулам. 2. В этом задании следует определить степени окисления представленных перед вами химических элементов по формуле бинарного соединения. 3. Перед вами представлены формулы. Назовите их соединения: 4. По названию этих веществ нужно составить формулы: |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: