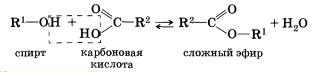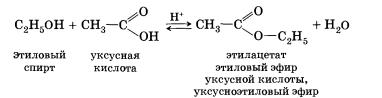|
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Спирты
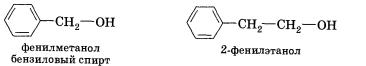
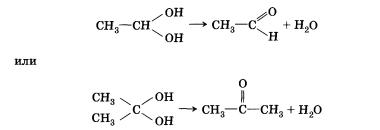
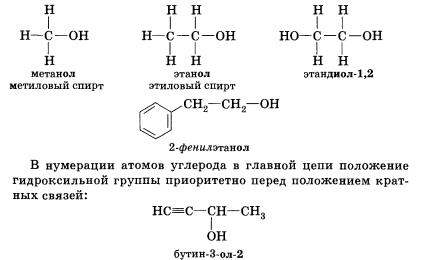
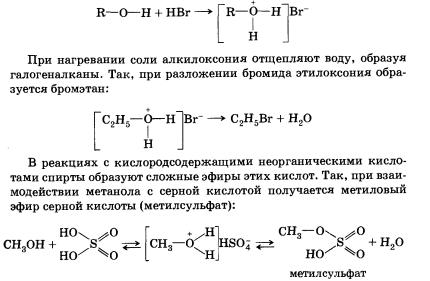
СтроениеСпиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом. По числу гидроксильных групп (атомности) спирты делятся на: • одноатомные По характеру углеводородного радикала выделяют следующие спирты: • предельные, содержащие в молекуле лишь предельные углеводородные радикалы Органические вещества, содержащие в молекуле гидрок-сильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например, гидроксибензол фенол. Подробнее со строением, свойствами и применением фенолов мы познакомимся позже. Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит). Следует заметить, что спирты, содержащие две гидроксильные группы при одном атоме углерода, неустойчивы и самопроизвольно разлагаются (подвергаются перегруппировке атомов) с образованием альдегидов и кетонов: Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид. По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на: • первичные, в молекулах которых гидроксильная группа связана с первичным атомом углерода Номенклатура и изомерияПри образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число: Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1; 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам. Рода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. Благодаря этому в молекулах спиртов имеются полярные связи С—О и О—Н. Физические свойства спиртовУчитывая полярность связи О—Н и значительный частичный положительный заряд, локализованный (сосредоточенный) на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал. Необходимо отметить, что атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность спиртам образовывать особые, так называемые водородные связи между молекулами. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу 32, в обычных условиях жидкость. Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и ок-танол уже не смешивается с водой. Химические свойстваСвойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы. 1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них). С водой это взаимодействие идет значительно активнее, чем со спиртом, сопровождается большим выделением тепла, может приводить к взрыву. Это различие объясняется электронодонорными свойствами ближайшего к гидроксильной группе радикала. Обладая свойствами донора электронов (+I-эффектом), радикал несколько повышает электронную плотность на атоме кислорода, «насыщает» его за свой счет, уменьшая тем самым полярность О—Н-связи и «кислотный» характер атома водорода гидроксильной группы в молекулах спиртов по сравнению с молекулами воды. 2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
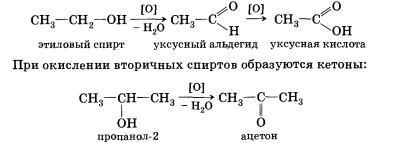
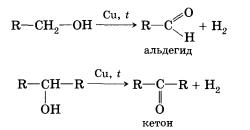
Данная реакция обратима. 3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств. В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 °С образуется диэтиловый (серный) эфир. 4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации): Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксус-аой кислоты образуется уксусноэтиловый эфир — этилацетат: 5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате ее образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксиль-ной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140 °С в присутствии концентрированной серной кислоты. 6. Окисление спиртов обычно проводят сильными окислителями, например дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты: Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе. 7. Дегидрирование спиртов. При пропускании паров спирта при 200—300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны: Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди(II). Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты. Алкоголяты щелочных и щелочноземельных металлов подвергаются гидролизу при взаимодействии с водой. Например, при растворении этилата натрия в воде протекает обратимая реакция Спирты могут проявлять основные свойства при взаимодействии с сильными кислотами, образуя соли алкилоксония благодаря наличию неподеленной электронной пары на атоме кислорода гидроксильной группы: Реакция этерификации обратима (обратная реакция — гидролиз сложного эфира), равновесие смещается вправо в присутствии водоотнимающих средств. Внутримолекулярная дегидратация спиртов протекает в соответствии с правилом Зайцева: при отщеплении воды от вторичного или третичного спирта атом водорода отрывается от наименее гидрированного атома углерода. Так, дегидратация бутанола-2 приводит к бутену-2, а не бутену-1. Наличие в молекулах спиртов углеводородных радикалов не может не сказаться на химических свойствах спиртов. Способы получения1. Гидролиз галогеналканов. Вы уже знаете, что образование галогеналканов при взаимодействии спиртов с галогено-водородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой. Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. 2. Гидратация алкенов — присоединение воды по тг-связи молекулы алкена — уже знакома вам. Гидратация пропена приводит в соответствии с правилом Марковникова к образованию вторичного спирта — пропанола-2
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов. 4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена). 5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода(II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка). Необходимую для этой реакции смесь угарного газа и водорода, называемую также (подумайте почему!) «синтез-газ», получают при пропускании паров воды над раскаленным углем. 6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен. Рассмотрим реакцию получения спиртов из галогеналканов — реакцию гидролиза галогенпроизводных углеводородов. Ее обычно проводят в щелочной среде. Выделяющаяся бромоводородная кислота нейтрализуется, и реакция протекает практически до конца. Эта реакция, как и многие другие, протекает по механизму нуклеофильного замещения. Это реакции, основной стадией которых является замещение, протекающее под воздействием нуклеофильной частицы. Напомним, что нуклеофильной частицей является молекула или ион, имеющая неподеленную электронную пару и способная притягиваться к «положительному заряду» — участкам молекулы с пониженной электронной плотностью. Наиболее распространенными нуклеофильными частицами являются молекулы аммиака, воды, спирта или анионы (гидроксил, галогенид, алкоксид-ион). Частицу (атом или группу атомов), замещаемую в результате реакции на нуклеофил, называют уходящей группой. Замещение гидроксильной группы спирта на галогенид-ион также протекает по механизму нуклеофильного замещения:
Интересно, что эта реакция начинается с присоединения катиона водорода к атому кислорода, содержащегося в гидроксильной группе:
Под действием присоединившегося положительно заряженного иона связь С—О еще больше смещается в сторону кислорода, эффективный положительный заряд на атоме углерода увеличивается. Это приводит к тому, что нуклеофильное замещение на галогенид-ион происходит гораздо легче, а отщепляется под действием нуклеофила молекула воды.
Получение простых эфировПри действии алкоголята натрия на бромэтан происходит замещение атома брома на алкоголят-ион и образуется простой эфир. Реакцию нуклеофильного замещения в общем виде можно записать следующим образом: R - X +HNu -> R - Nu +HX, если нуклеофильной частицей является молекула (НВг, Н20, СН3СН2ОН, NН3, СН3СН2NН2), или
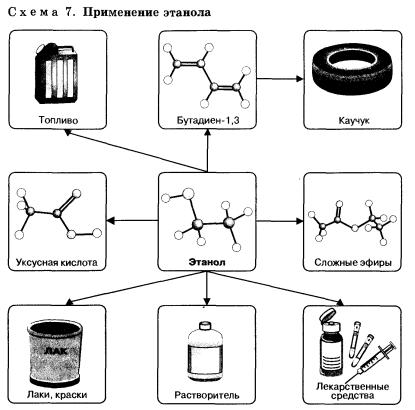
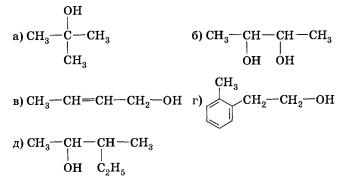
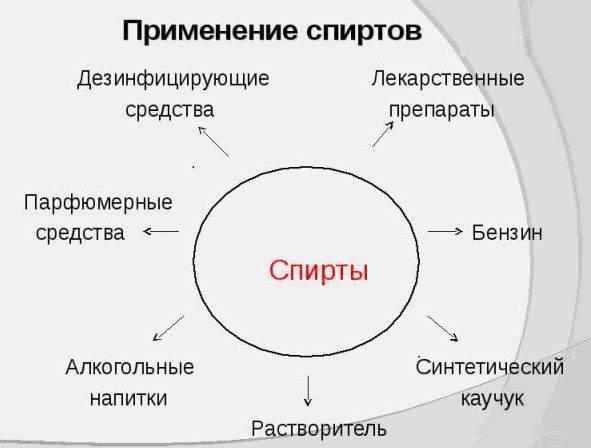
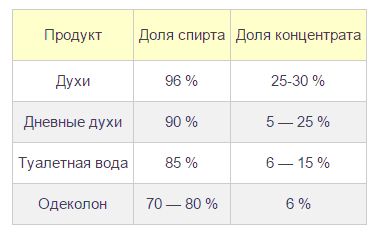
если нуклеофилом является анион (ОН , Вг-, СН3СН2O-), где X — галоген, Nu — нуклеофильная частица. Отдельные представители спиртов и их значениеМетанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт — объясняется одним из способов его получения — перегонкой твердых пород дерева (греч. — вино, опьянеть; вещество, древесина). Метанол очень ядовит! Он требует осторожного обращения при работе с ним. Под действием фермента алкогольде-гидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть. Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96% (по объему) этанола и 4% (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди(II) и др.). Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным или денатуратом. Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков. Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма. Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты. В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление. Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени. Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах, значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания. Пропантриол-1,2,3 (глицерин) — вязкая, сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел. Широко используется в косметике, фармацевтической и пищевой промышленности. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание. К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и таким образом придавая пластмассам необходимую гибкость и эластичность. 1. Какие вещества называются спиртами? По каким призна-[ кам классифицируют спирты? К каким спиртам следует - отнести бутанол-2? бутен-З-ол-1? пентен-4-диол-1,2? 3. Существуют ли четвертичные спирты? Объясните ответ. 4. Сколько спиртов имеют молекулярную формулу С5Н120? Составьте структурные формулы этих веществ и назовите их. Только ли спиртам может соответствовать эта формула? Составьте структурные формулы двух веществ, имеющих формулу С5Н120 и не относящихся к спиртам. 5. Назовите вещества, структурные формулы которых приведены ниже: 6. Напишите структурную и эмпирическую формулы вещества, название которого 5-метил-4-гексен-1-инол-3. Сравните число атомов водорода в молекуле этого спирта с числом атомов водорода в молекуле алкана с таким же числом атомов углерода. Чем объясняется это различие? 7. Сравнив электроотрицательности углерода и водорода, объясните, почему ковалентная связь О—Н более поляр-на, чем связь С—О. 8. Как вы думаете, какой из спиртов — метанол или 2-ме-тилпропанол-2 — будет активнее реагировать с натрием? Объясните свой ответ. Составьте уравнения соответствующих реакций. 9. Составьте уравнения реакций взаимодействия пропанола-2 (изопропилового спирта) с натрием и бромоводородом. Назовите продукты реакций и укажите условия их осуществления. 10. Смесь паров пропанола-1 и пропанола-2 пропустили над нагретым оксидом меди(П). Какие реакции могли произойти при этом? Составьте уравнения этих реакций. К каким классам органических соединений относятся их продукты? 11. Какие продукты могут образоваться при гидролизе 1,2-дихлорпропанола? Составьте уравнения соответствующих реакций. Назовите продукты этих реакций. 12. Составьте уравнения реакций гидрирования, гидратации, галогенирования и гидрогалогенирования 2-пропе-нола-1. Назовите продукты всех реакций. 13. Составьте уравнения взаимодействия глицерина с одним, двумя и тремя молями уксусной кислоты. Напишите уравнение гидролиза сложного эфира — продукта этерификации одного моля глицерина и трех молей уксусной кислоты. 14*. При взаимодействии первичного предельного одноатомного спирта с натрием выделилось 8,96 л газа (н. у.). При дегидратации той же массы спирта образуется алкен массой 56 г. Установите все возможные структурные формулы спирта. 15*. Объем углекислого газа, выделившегося при сжигании предельного одноатомного спирта, в 8 раз превосходит объем водорода, выделившегося при действии избытка натрия на то же количество спирта. Установите строение спирта, если известно, что при его окислении образуется кетон. ПрименениеТак как спирты имеют разнообразные свойства, то и область из применения довольно таки обширна. Давайте с вами попробуем разобраться, где же применяются спирты. Пищевая промышленностьТакой спирт, как этанол является основой всех алкогольных напитков. А получают его из сырья, которое содержит сахар и крахмал. Таким сырьем может быть сахарная свекла, картофель, виноград, а также разные злаковые культуры. Благодаря современным технологиям при производстве спирта происходит его очистка от сивушных масел. В натуральном уксусе также присутствует сырье, полученное на основе этанола. Этот продукт получается благодаря окислению уксуснокислым бактериям и аэрированию. Но в пищевой промышленности используют не только этанол, но и глицерин. Эта пищевая добавка способствует соединению несмешиваемых жидкостей. Глицерин, который входит в состав ликеров, способен придавать им вязкость и сладкий вкус. Также, глицерин применяют при изготовлении хлебобулочных, макаронных и кондитерских изделиях. МедицинаВ медицине этанол просто незаменим. В этой отрасли он широко применяется в качестве антисептика, так как обладает свойствами, которые способны уничтожать микробы, задерживать болезненные изменения в крови и не допускают разложения в открытых ранах. Этанолом пользуются медицинские работники перед проведением различных процедур. Этот спирт обладает свойствами обеззараживания и просушивания. При проведении искусственной вентиляции легких, этанол выступает в роли пеногасителя. А также этанол может быть одним из компонентов при анестезии. При простуде этанол можно использовать, как согревающий компресс, а при охлаждении, как средство для растирания, так как его вещества способствуют восстановлению организма при жаре и ознобе. В случае отравления этиленгликолем или метанолом, применение этанола способствует уменьшению концентрация токсичных веществ и выступает в роли противоядия. Также огромную роль спирты оказывают фармакологии, так как они используются для приготовления целебных настоек и всевозможных экстрактов. Парфюмерия и косметикаВ парфюмерии без спиртов также никак не обойтись, так как основой практически всех парфюмерных продуктов является вода, спирт и парфюмерный концентрат. Этанол в этом случае выступает в роли растворителя душистых веществ. А вот 2-фенилэтанол обладает цветочным запахом и в парфюмерии может заменить натуральное розовое масло. Его применяют при изготовлении лосьонов, кремов и т.д. Глицерин также является основой базы для многих косметических средств, так как имеет способность притягивать влагу и активно увлажнять кожу. А присутствие этанола в шампунях и кондиционерах способствует увлажнению кожных покровов и облегчает расчесывание волос после мытья головы. ТопливоНу а такие спиртосодержащие вещества, как метанол, этанол и бутанол-1 широко используются в качестве топлива. Благодаря переработке такого растительного сырья, как сахарный тросник и кукуруза, удалось получить биоэтанол, который является экологически чистым биотопливом. В последнее время производство биоэтанола стало популярным в мире. С его помощью появилась перспектива в возобновлении топливных ресурсов. Растворители, поверхностно-активные вещества Кроме уже перечисленных сфер применения спиртов, можно отметить и то, что они еще являются и хорошими растворителями. Наибольшей популярностью в этой области пользуются изопропанол, этанол, метанол. Они также используются при производстве битовой химии. Без них не возможен полноценный уход за автомобилем, одеждой, домашней утварью и т.д. Использование спиртов в разных сферах нашей деятельности положительно влияет на нашу экономику и приносит комфорт в нашу жизнь. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: