|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Генетичні зв’язки між класами неорганічних сполук. Значення експериментального методу в хімії
Тобі вже відомі деякі неорганічні речовини та ознаки їх поділу на окремі класи. Тепер треба передусім узагальнити знання про класифікацію речовин і перевірити уміння здійснювати її.
Поняття «класифікація» не є хімічним. Воно — загальнонаукове, оскільки рівною мірою належить усім наукам. Адже на ранніх етапах розвитку будь-якої науки спочатку збираються факти, далі їх класифікують, тобто об'єднують у групи за однією або кількома загальними ознаками і т. д.
основною ознакою є їх хімічний склад. Саме за складом усі неорганічні речовини поділяють на групи, класи, яким
характерні спільні хімічні властивості. Повторити й узагальнити свої знання про них тобі допоможе схема класифікації неорганічних речовин (мал. 6).
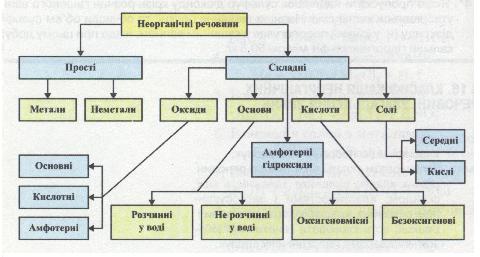
Мал. 6. Схема класифікації неорганічних речовин
Розглядаючи схему, постарайся відповісти на запитання й виконати завдання, наведені нижче. Якщо ти відчуєш труднощі або захочеш перевірити правильність своєї відповіді, звернися до тексту підручників 7-го і 8-го класів.
ЗАПИТАННЯ Й ЗАВДАННЯ
1. Які речовини називаються простими? На які дві групи вони поділяються? Наведи приклади.
2. Які речовини називаються складними?
3. На які класи поділяються складні неорганічні речовини? Наведи відповідні приклади.
4. Які речовини називаються оксидами? За якою ознакою і як їх класифікують?
Зверни увагу, коли розглядався клас оксидів, то вивчалася лише одна їх хімічна властивість — здатність оксидів неметалів взаємодіяти з водою, утворюючи кислоти, через що їх і називають кислотними оксидами, і здатність оксидів активних металів також взаємодіяти з водою, але утворювати при цьому луги (розчинні основи), через що їх називають основними оксидами. Під час вивчення хімічних властивостей інших класів сполук (кислот, основ, солей) траплялися реакції, що ілюструють інші хімічні властивості оксидів. Отже, тепер є нагода узагальнити знання про хімічні властивості оксидів (табл. 8).
Таблиця 8. Хімічні властивості оксидів
Зверни увагу на останнє рівняння реакції. Тут висвітлюється нова хімічна властивість оксидів — здатність реагувати між собою з утворенням солі, але за умови, що вони різні за складом, протилежні за властивостями: один — оксид металу (основний), інший — оксид неметалу (кислотний).
5. Що таке основа? Який склад цих речовин? Які властивості для них характерні?
6. Які речовини називають кислотами? Як їх класифікують? Які властивості для них характерні?
7. Які речовини належать до солей? З якими речовинами можуть взаємодіяти солі?
Ознайомлення з хімічними властивостями основних класів неорганічних сполук показує, що між ними існує взаємозв'язок, який можна подати такою схемою:
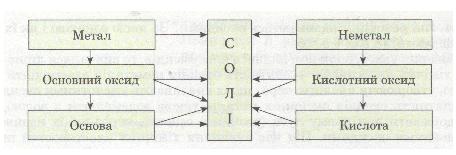
Мал. 7. Схема.
• Розглянь схему й подумай, які ще можливі шляхи одержання солей.
Із схеми видно, що існує два ряди речовин із протилежними властивостями (див. по вертикалі). Один ряд:
Метал → Основний оксид → Основа
характерний для елемента-металу. Другий ряд:
Неметал → Кислотний оксид → Кислота
характерний для елемента-неметалу.
Простежується генетичний зв'язок між речовинами всередині ряду і між рядами. У взаємодії речовин (див. по горизонталі) виявляється протилежність властивостей: метали реагують з неметалами; основні оксиди — з кислотними оксидами і кислотами; основи — з кислотами та кислотними оксидами.
Отже, речовини взаємозв'язані. З речовин одного класу за допомогою різноманітних хімічних реакцій можна добути речовини іншого класу.
Висновки
Складні неорганічні речовини поділяються на класи: оксиди, основи, кислоти і солі. Кожний із цих класів, у свою чергу, поділяється на групи. Так, оксиди бувають основні, кислотні та амфотерні. Основи — розчинні у воді (луги) і нерозчинні. Кислоти за складом класифікують на оксигеновмісні та безокси-генові, а за основністю — на одно-, двох-, три- і багатоосновні. Солі поділяють на середні й кислі.
Усі речовини між собою взаємозв'язані за походженням і за реакціями як між простими речовинами, так і між простими і складними речовинами, між складними речовинами — представниками різних класів, між речовинами взагалі.
Існує підпорядкованість речовин та їх перетворень загальним законам. Знання взаємозв'язків між речовинами потрібні людині для керування їх перетвореннями, для добування нових сполук, потрібних у промисловому виробництві, сільському господарстві, побуті тощо.
Завдання для самоконтролю
1. Із наведеного переліку формул речовин випиши окремо формули оксидів, кислот, основ, солей і зазнач їх назви: НСІ, H2SiO3, К2O, NaOH, Ва(ОН)2, К2СO3, HNO3, Fe(OH)3, H2S, SO2, H2SO4, Al2O3, Mg3(PO4)2, FeSO4.
2. Порівняй склад: а) оксидів і основ; б) оксидів і кислот; в) кислот і солей; г) основ і солей. Чим вони подібні і чим відмінні?
3. З якими речовинами, формули яких наведено, може взаємодіяти кальцій оксид: НСІ, NaOH, Н2O, СO2, H2SO4, MgO? Напиши рівняння можливих реакцій.
4. З якими речовинами, формули яких НСІ, Са(ОН)2, FeO, СO2, H2SO4, може реагувати натрій гідроксид? Напиши рівняння можливих реакцій.
5. У двох пробірках (без етикеток) містяться тверді речовини. Відомо, що це кальцій оксид і ферум(ІІІ) оксид. Як визначити, де яка речовина?
6. Склади чотири рівняння відомих тобі типів реакцій, в яких вода є або вихідним реагентом, або кінцевим продуктом.
7. Напиши рівняння реакцій, що показують зв'язок між речовинами різних класів, поданий у загальному вигляді такою схемою:
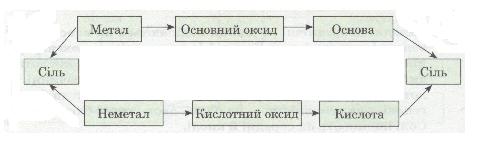
Мал. 8. Схема.
Додаткові завдання
8*. Напиши рівняння реакцій, що відповідають перетворенням у такому генетичному ряду:
натрій → натрій гідроксид → натрій сульфат → натрій хлорид → натрій нітрат.
9*. Напиши рівняння реакцій добування:
а) калій гідроксиду трьома способами; б) кальцій ортофосфату чотирма способами.
10*. Якщо на натрій гідроксид подіяти карбон(ІУ) оксидом, який виділяється внаслідок взаємодії з хлоридною кислотою кальцій карбонату масою 500 кг, то можна добути натрій карбонат масою:
(а) 550 кг; (б) 530 кг; (в) 520 кг; (г) 510 кг.
11*. Воднем (н. у.), що виділяється внаслідок взаємодії алюмінію з сульфатною кислотою масою 588 г, можна відновити з ферум(ІІІ) оксиду залізо кількістю речовини:
(а) 1 моль; (б) 2 моль; (в) 3 моль; (г) 4 моль.
12*. Цинкову пластинку масою 20,1 г занурено в розчин плюмбум(ІІ) нітрату. Після завершення реакції маса пластинки стала 27,1 г. Маса свинцю, що осів на пластинці (вважати, що весь свинець виділився), дорівнює:
(а) 10,2 г; (б) 20,4 г; (в) 5,1 г; (г) 51 г.
13*. Обчисли масу купрум(ІІ) сульфіду, що утворився внаслідок пропускання сірководню об'ємом 5,6 л (н. у.) крізь розчин купрум(ІІ) сульфату об'ємом 208,9 мл з масовою часткою розчиненої речовини 18 % і густиною 1,2 г/мл. Яка маса купрум(ІІ) сульфату залишиться в розчині?
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Хімія онлайн, підручники та книги по всім предметам, уроки хімії для учнів 8 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|














