|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
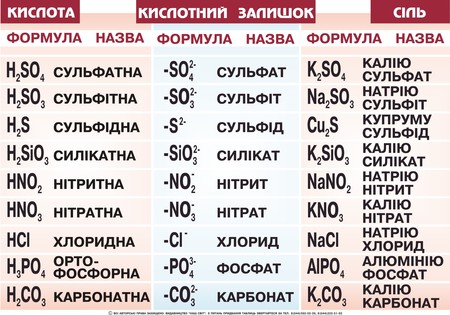
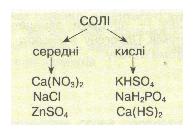
Хід урокуСутність солейСолі – кристалічно тверді речовини, які можна розглядати як продукти повного чи часткового заміщення йонів гідрогену кислоти металом або гідроксид-іонів основ (чи амфотерних гідроксидів) – кислотними залишками. Мал. 1. Види кислот, їх формули назви, кислотний залишок та утворювана сіль. За хімічними властивостями та складом солі поділяються на середні, кислі, основні, координаційні (комплексні) та подвійні. Середні солі можна розглядати як продукти повного заміщення гідрогену кислоти на метал або металоподібну групу атомів. Наприклад: NaCl, Na2SO4, Al(NO3)3, Na3PO4, CaCO3. Кислі солі – це продукти неповного заміщення гідрогену багато основної кислоти металом. Наприклад: Ca(HCO3)2, NaH2PO4, Na2HPO4, Pb(HSO4)2. Мал. 2. Види солей. Основні солі – продукти неповного заміщення гідроксид-іонів основи чи амфотерного оксиду кислотними залишками: Al(OH)2Cl, Cu2(OH)2CO3, MG(OH)Cl. Подвійні солі утворюються в результаті сумісної кристалізації двох солей з однаковим аніоном, що мають однакові кристалічні гратки: KAl(SO4)2, (NH4)2Fe(SO4)2, NH4MgPO4. Комплексні (координаційні) солі – це такі сполуки, кристалічні решітки яких складаються з комплексних груп, що утворюються внаслідок взаємодії за донорно-акцепторним або обмінним механізмами зв’язку йонів або молекул, які можуть існувати самостійно: [(Cu(NH3)4]SO4, Na3[AlF6]. Про деякі інші види солей ви можете дізнатися з наступного відео. Відео 1. Види солей.
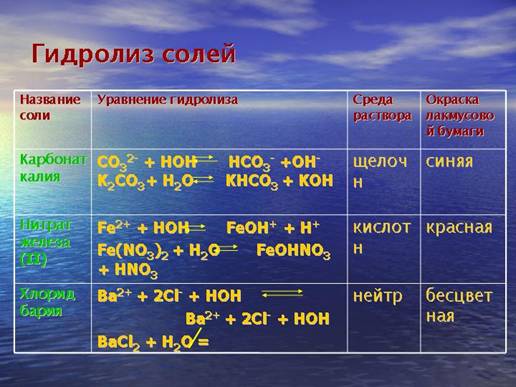
Назви солей утворюються з назви катіонів та аніонів з відповідними префіксами, із зазначенням в круглих дужках (при потребі) ступеня окиснення відповідного елемента: CrSO4 – хром (II) сульфат, Fe(NO3)3 – ферум (III) нітрат, Na[Sb(OH)6] – натрій гексагідроксостибат (V), (NH4)2Cr2O7 – діамоній дихромат (VI). Кислі солі називають наступним чином: KHCO3 – калій гідроген карбонат, Ba(HSO3)2 – барій гідроген сульфат (IV), (NH4)2HPO4 – діафоній гідроген фосфат, Ca(H2PO4)2 – кальцій дигідрогенфосфат, NaHS – натрій гідроген сульфід, CaH2P2O7 – кальцій дигідрогендифосфат. Контролюючий блок 11. Що являють собою солі? Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солямиВзаємодія з водою – гідроліз. Гідролізу підлягають солі, утворені слабкими основами (або амфотерними гідроксидами) та сильними кислотами, слабкими кислотами та сильними основами, слабкими кислотами та слабкими основами або амфотерними гідроксидами: FeCl3 + H2O = Fe(OH)Cl2 + HCl; Fe(OH)Cl2 + H2O = Fe(OH)2Cl + HCl; Al(CH3COO)3 + H2O = Al(OH)(CH3COO)2 + CH3COOH; NH4Cl + H2O = NH4OH + HCl. Мал. 4. Гідроліз солей. Детальніше ознайомитися з процесом гідролізу солей ви можете з наступного відео. Відео 2. Гідроліз солей.
Взаємодія солей з металми: Fe + CuSO4 = FeSO4 + Cu; 2AgNO3 + Cu = Cu(NO3)2 + 2Ag. Взаємодія між солями: BaCl2 + Na2CO3 = BaCO3 + 2NaCl; Ca(NO3)2 + Na2SO4 = CaSO4 + 2NaNO3. Взаємодія солей з кислотами: Na2SiO3 + 2HCl = 2NaCl + H2SiO3; 3Al(OH)2Cl + 6HNO3 = AlCl3 + 2Al(NO3)3 + 6H2O. Взаємодія солей з лугами: 6Ca(H2PO4)2 + 18NaOH = 2Ca3(PO4)2 + 6Na3PO4 + 21H2O; CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4. Кислі та основні солі при нагріванні втрачають воду, нітрати лужних металів – розкладаються з виділенням диоксигену, а при розкладі нітратів важких металів, крім диоксигену, виділяється ще й нітроген диоксиген. Карбонати лужних металів плавляться без розкладу, а карбонати двовалентних та лужноземельних металів розкладаються з виділенням СО2. Як можна власне виробити кристали солі ви можете побачити на запропонованому нижче відео. Відео 3. Вирощення кристалів солі.
Термічно нестійкими є також солі амонію. Дисульфати при нагріванні виділяють SO3. Нижче наведені приклади термічного розкладу солей: KH2PO4 = KPO3 + H2O; Контролюючий блок 21. Які хімічні властивості солей ви знаєте? Домашнє завдання
Цікаво знати, що…У насичений розчин сірки в бензині або толуені занурюють стрічку мідної бляхи або мідну платівку. Занурена поверхня металу вмить чорніє. Якщо ж мідь залишити в розчині сірки на декілька діб, а то й на цілий тиждень, - вона зникне, бо сірка повністю «зїдає» метал. Натомість у склянці знайдемо чорні із синюватим відблиском кристали купрум (І) сульфіду: 2Cu + S = Cu2S. Цю ж реакцію можна провести інакше. У колбі нагрівають до кипіння сірку, а потім в її пару вносять пучок попередньо підігрітих мідних дротинок. У сірковій парі мідь спалахує та енергійно згоряє. При цьому утворюється чорний дим купрум (І) сульфіду. Список використаних джерел1. Урок на тему «Солі, їх поширення у природі» Осмінкіної Л. М. СЗШ № 28, м. Астрахань.
Осмінкіна Л.М. Русецька О.П. Лісняк А,В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: