|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімічний зв’язок і будова речовин ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИН
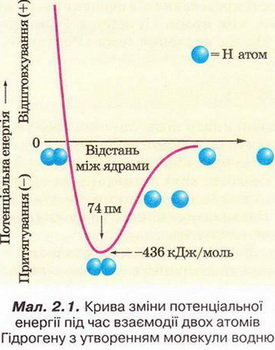
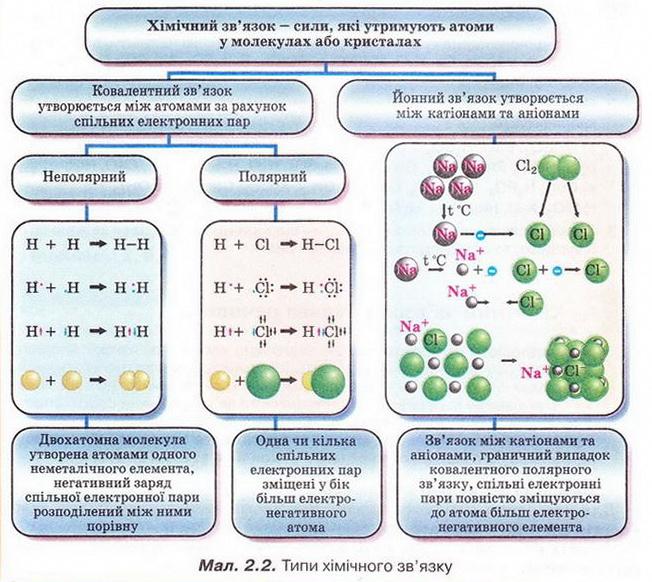
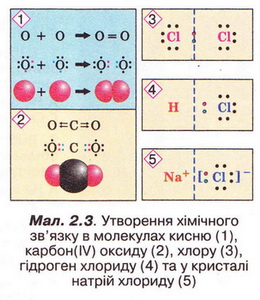
Аби відповісти на запитання: що називають хімічним зв'язком? Яка його природа? Що таке електронегативність? Як змінюється електронегативність у періодах і групах? Яким чином утворюються ковалентний та йонний зв'язки? Чим відмінні та подібні різні типи хімічного зв'язку? У який спосіб описують внутрішню будову кристалів? Для чого використовують знання про хімічний зв'язок і будову речовини? - пригадайте курс хімії 8-го класу, проаналізуйте малюнки та схеми й виконайте тестові завдання. Виберімо правильні твердження. Для утворення хімічного зв'язку між двома атомами необхідно, щоб енергія системи з двох атомів: А Була нижчою за енергію окремо взятих атомів; Б Була вищою за енергію окремо взятих атомів; В Дорівнювала енергії окремо взятих атомів; Г Була б спочатку нижчою, а згодом - вищою за енергію окремо взятих атомів. Відповідь. А. Ковалентним зв'язком сполучені атоми: А Металічних елементів; Б Неметалічних і металічних елементів; В Неметалічних елементів; Г Інертних елементів. Відповідь. В. Йонним зв'язком сполучені атоми: А Металічних елементів; Б Неметалічних і металічних елементів; В Неметалічних елементів; Г Лужних елементів. Відповідь. Б. Завдання 2. Виберіть формули речовин із ковалентним полярним зв'язком: 3. Виберіть формули речовин із ковалентним неполярним зв'язком: Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку (мал. 2.3). Завдання Завдання човин і типами хімічного зв'язку у них:
Завдання Встановіть відповідність між типами хімічного зв'язку у бінарних сполуках і хімічними елементами, які входять до їхнього складу:
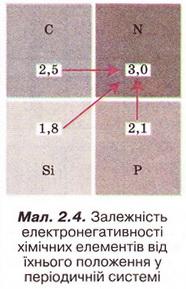
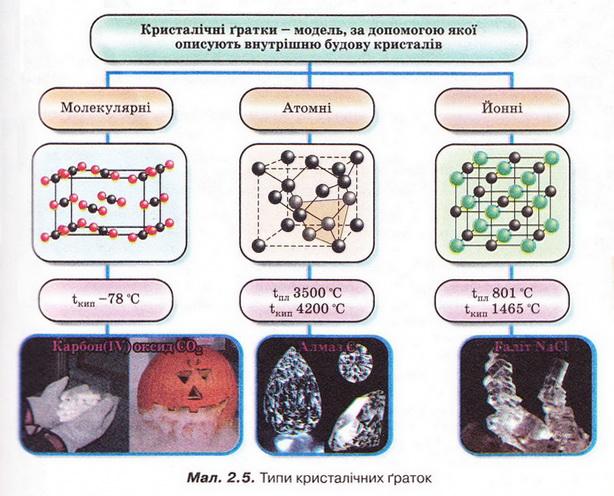
Електронегативність хімічного елемента — це властивість його атома притягувати спільні з іншим атомом електронні пари. Завдання 2. Виберіть правильне твердження. У періодах зі збільшенням кількості електронів в атомах електронегативність елементів: 3. Розташуйхе хімічні елементи за зростанням їхньої електронегативності: 4. Розташуйте хімічні елементи за зменшенням їхньої електронегативності: 5. Виберіть правильні записи (х - електронегативність): Виберімо характеристику речовин з йонними кристалічними ґратками: А Високі температури плавлення; Б Низькі температури кипіння; В Молекули у вузлах кристалічних ґраток; Г Різкий запах. Відповідь, А. Виберімо характеристики речовин з молекулярними кристалічними ґратками: А Невисокі температури плавлення; Б Невисокі температури кипіння; В Молекули у вузлах кристалічних ґраток; Г Висока твердість; Д Атоми у вузлах кристалічних ґраток. Відповідь. А, Б, В. Завдання Виберіть характеристики речовин з атомними кристалічними ґратками: Стисло про головне Хімічним зв'язком називають сили, які утримують атоми в молекулах або кристалах. Він має електронну природу. Зв'язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул. Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільних електронних пар розподілений між ними порівну. Такий зв'язок називають ковалентним неполярним. Електронегативність хімічного елемента - це властивість його атома притягувати спільні з іншим атомом електронні пари. Зі зростанням протонного числа електронегативність хімічних елементів зростає у періодах і зменшується у підгрупах. Ковалентний зв'язок, у якому одна чи кілька спільних електронних гар зміщені у бік більш електронегативного атома, називають полярним зв’язком. Йонний зв'язок - це зв'язок між катіонами та аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв'язку. Якщо різниця в електронегативності атомів хімічних елементів дуже велика, спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони, завершуючи у такий спосіб зовнішній енергетичний рівень. Межа між ковалентним полярним та йонним зв'язком дещо умовна. Різниця електронегативностей хімічних елементів дає змогу визначити, і в : кільки хімічний зв'язок у сполуці відрізняється від чисто ковалентного. Кристалічні ґратки - модель, за допомогою якої описують знутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: йонні, атомні, молекулярні. Молекулярні речовини мають низькі температури плавлення й кипіння, адже молекули слабко зв'язані між собою. Речовини, що маютьатомні кристалічні гратки, плавляться за високих температур, практично нерозчинні у будь-яких розчинниках, мають низьку реакційну здатність. У йонних кристалах зв’язки між йонами міцні, тому такі кристали зазвичай мають високі температури плавлення. Вони тверді, але крихкі. Властивості сполук залежать від їхньої будови і зумовлюють застосування речовин. Застосуйте свої знання й уміння 1. Виберіть хімічний елемент, атоми якого під час утворення молекул у хімічних реакціях намагаються набути стійкої зовнішньої оболонки з двох електронів: 2. У молекулі брому тип хімічного зв’язку: Він утворений за рахунок: 3. У молекулі гідроген сульфіду тип хімічного зв’язку: Він утворений за рахунок: 4. У кристалічних ґратках алмазу містяться: Вони зв’язані між собою: 5. Опишіть зображені на малюнку 2.6 зміни, які відбуваються з йодом за слабкого нагрівання. Зробіть висновок про тип кристалічних ґраток цієї речовини. 6. Спрогнозуйте тип кристалічних ґраток у речовинах за описом їхніх властивостей і застосування: а) камфора (компонент мазей, крапель та інших лікарських форм) - безбарвні леткі кристали з характерним запахом; б) ванілін (ароматизатор кондитерських виробів) - безбарвні, з приємним запахом; в) бор нітрид ВN (боразон) за твердістю наближається до алмазу, водночас стійкіший до високих температур, його використовують для виготовлення надтвердих абразивних матеріалів. 7. Обчисліть об'єм газу (н. у.), який утвориться під час сублімації сухого льоду (карбон(ІV) оксиду) масою 220 г.
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 9 класу
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: