|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Фізичні властивості середніх солей. Поширення солей у природі та їхнє практичне значення. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
Хід урокуЗагальна характеристика та фізичні властивості середніх солейЯк ви вже знаєте, солі – це продукт реакції нейтралізації, а саме – взаємодії кислоти і основи. Солі розподіляють за складом на середні, кислі, основні, подвійні та комплексні (змішані). Рівняння дисоціації середньої солі можна записати так: K2SO4 = 2K + SO4. Солі в основному – тверді кристалічні речовини. Їх можна поділити на розчинні, малорозчинні та практично нерозчинні. Хімічні властивості солей зумовлюються їх відношенням до металів, кислот і солей. Щоб навчитися розпізнавати деякі солі, пропонуємо вам переглянути наступне відео. Відео 1. Розпізнавання солей.
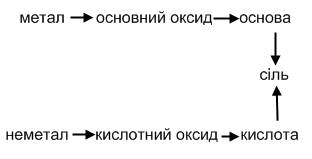
Під час проведення реакцій обміну у розчинах вони відбуваються до кінця лише в тому разі, коли утворюється осад, газ або малодисоційована сполука. Генетичний зв'язок між класами неорганічних сполук можна виразити за наступною схемою: Мал. 2. Схема генетичного зв’язку між неорганічними сполуками. Контролюючий блок 1
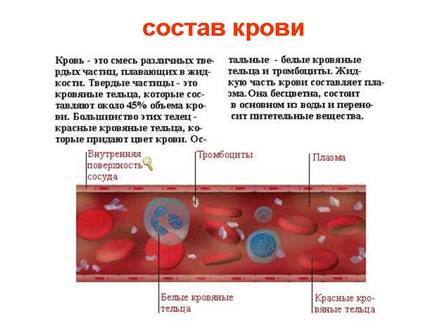
Поширення солей у природі, їх значенняСолі доволі поширені у природі й відіграють важливу роль у процесах обміну речовин у живих організмах. Солі містяться в клітинному соку, крові, сльозах, поті, входять до складу різних тканин: кісткової, нервової, м'язової. Мал. 3. Склад крові. Масова частка солей в організмі людини становить 5,5 %. Живі організми потребують постійного надходження солей. Тваринні організми одержують їх із питною водою та харчовими продуктами, а в рослини солі надходять з ґрунту разом з водою. Солі мають велике значення і в суспільному господарстві. їх використовують для добування багатьох металів, мінеральних добрив, скла, мінеральних фарб, миючих засобів, кислот тощо. Солі сірчаної кислоти. У будівництві і в медицині широко використовують напівводяний гіпс, який одержано при випалюванні гірської породи (дигідрат сульфату кальцію). Будучи змішаний з водою, він швидко застигає, утворюючи дигідрат сульфату кальцію, тобто гіпс. Щоб більше дізнатися саме про сірчану кислоту, до вашої уваги наступне відео. Відео 2. Окисні властивості сірчаної кислоти.
Декагідрат сульфату натрію використовують як сировину для одержання соди. Солі азотної кислоти. Нітрати найбільше використовують в якості добрив у сільському господарстві. Найважливішим із них є нітрат натрію, нітрат калію, нітрат кальцію і нітрат амонію. Зазвичай ці солі називають селітрами. Мал. 4. Селітра. Солі вугільної кислоти. Карбонат кальцію використовують в якості сировини для отримання вапна. Карбонат натрію (соду) застосовують у виробництві скла і при варінні мила. Як взаємодіють між собою карбонат натрію та сірчана кислота ви дізнаєтеся, якщо переглянете наступне відео. Відео 3. Взаємодія карбонату натрію та сірчаної кислоти.
Мал. 5. Карбонат натрію (сода). Карбонат кальцію в природі зустрічається і у вигляді вапняку, крейди і мармуру. Контролюючий блок 2
Домашнє завданняДайте відповідь на наступне питання та обґрунтуйте її. Чому гідроліз солей багато основних кислот або багато кислотних основ оцінюється зазвичай тільки його першим ступенем? Цікаво знати, що…Не кожен знає, як створити в хімічній лабораторії штучні водорості. Наповніть шість пробірок майже доверху п'ятдесятивідсотковим розчином силікату натрію (рідкого скла). Потім в першу з них киньте декілька кристаликів хлорного заліза, в другу - хлористої міді, в третю - хлористого кобальту, у четверту - хлористого нікелю, у п'яту - хлористого марганцю, в шосту - хлористого алюмінію. Через деякий час починається зростання «водоростей » химерної форми і різного забарвлення. У розчині солі заліза «водорості» бурого кольору, солі кобальту - синього, солі алюмінію - безбарвні і т. д. Чому це відбувається? Кинуті в розчин рідкого скла кристалики реагують з силікатом натрію. Утворені сполуки покривають кристали тонкою плівкою, а в зв’язку з дифузією вода проникає крізь неї, тиск в кристалах підвищується і плівка лопається. Через отвори розчин солей проникає в навколишню рідину і швидко знову покривається плівкою. Потім плівка знову проривається. Так виростають розгалужені «водорості». Список використаних джерел1. Урок на тему «Солі, їх поширення у природі» Осмінкіної Л. М. СЗШ № 28, м. Астрахань.
Осмінкіна Л.М. Сискова Р.Ф. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: