|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Углерод Строение и свойства атомов. Углерод С — первый элемент главной подгруппы IV группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне 4 электрона, поэтому они могут принимать четыре электрона, приобретая при этом степень окисления -4, т. е. проявлять окислительные свойства и отдавать свои электроны более электроотрицательным элементам, т. е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.
Углерод — простое вещество. Вы уже знаете, что углерод образует аллотропные модификации — алмаз и графит.
Алмаз — прозрачное кристаллическое вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая по десятибалльной системе оценивается высшим баллом 10. Такая твердость алмаза обусловлена особой структурой его атомной кристаллической решетки (рис. 37). В ней каждый атом углерода окружен такими же атомами, расположенными в вершинах правильного тетраэдра.
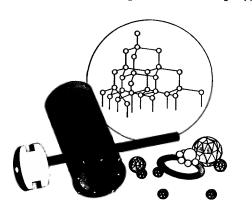 Рис. 37. Строение алмаза и его применение: Рис. 37. Строение алмаза и его применение:
бриллианты, наконечники бура, алмаз в оправе для резки стекла, алмазный «карандаш»
Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности.
Алмазы были известны еще в древности. Само слово «алмаз» происходит или от арабского алмас, что означает «твердейший», или от греческого слова адамас, т. е. «несокрушимый, непреодолимый». Массу алмазов измеряют в каратах, 1 карат соответствует 0,2 г. Ограненные прозрачные алмазы называются бриллиантами. Они украшают короны царей бывшей Российской империи, орден Святого Андрея Первозванного (рис. 38). Крупные алмазы имеют свою биографию и носят имена. Самый крупный из найденных алмазов — это «Кулли-нан» из Южной Африки (3025 каратов). В Алмазном фонде России хранится знаменитый алмаз «Шах» в 87 каратов (рис. 39). Им персидское правительство расплатилось за жизнь известного писателя и дипломата А. С. Грибоедова, погибшего в Тегеране в 1829 г.
Алмазы — это не только камни ювелиров. Благодаря исключительно высокой твердости алмазов они применяются для изготовления буров, сверл, шлифовальных инструментов, резки стекла.
Крупнейшие месторождения алмазов находятся в Южной Африке, а в России их добывают в Якутии.
Графит — темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском. В отличие от алмаза графит мягкий (оставляет след на бумаге) и непрозрачный, хорошо проводит тепло и электрический ток. Мягкость графита обусловлена слоистой структурой (рис. 40). В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны. Он очень тугоплавок.

---- Звезда восьмилучевая сплошь усыпана бриллиантами различной величины и украшена тринадцатью мелкими сапфирами.
----
Из графита изготовляют электроды (вспомните электролитическое получение алюминия), твердые смазки, замедлители нейтронов в ядерных реакторах, стержни для карандашей. При высоких температурах и давлениях из графита получают искусственные алмазы, которые широко применяются в технике.
Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Этот уголь благодаря своей пористой поверхности обладает замечательной способностью поглощать газы и растворенные вещества. Это свойство называется адсорбцией. Чем больше пористость древесного угля, тем эффективнее адсорбция. Чтобы увеличить поглотительную способность, древесный уголь обрабатывают горячим водяным паром. Обработанный таким способом уголь называют активированным или активным. В аптеках его продают в виде черных таблеток карболена.
Если бросить кусочки активированного угля в колбу с бурым газом NO2, то бурая окраска в колбе исчезнет. На поглотительной способности активированного угля основано действие противогазов — устройств для защиты от вредных примесей, имеющихся в воздухе. Первый противогаз был изобретен выдающимся русским химиком Н. Д. Зелинским и спас жизнь тысячам солдат в период первой мировой войны.
Николай Дмитриевич Зелинский (1861-1953) 
усский химик-органик, академик АН СССР (с 1929). Один из основоположников учения об органическом катализе. Занимался вопросами химии нефти. Синтезировал ряд аминокислот, оксиаминокислот и многих других органических веществ. Совместно с инженером А. Кумантом (1915) создал противогаз.
Активированный уголь широко применяется в промышленности для очистки многих продуктов, например спирта, от сивушных масел, сахарного сиропа от окрашенных веществ, для улавливания бензина из природных газов.
Теперь перейдем к рассмотрению химических свойств углерода.
Алмаз и графит соединяются с кислородом при очень высокой температуре. Сажа и уголь взаимодействуют с кислородом гораздо легче, сгорая в нем. Но в любом случае результат такого взаимодействия один — образуется углекислый газ:
С + 02 = С02
(какие свойства — восстановительные или окислительные проявляет в этой реакции углерод?).
С металлами углерод при нагревании образует карбиды, например:
4Аl + ЗС = Аl4С3
(какие свойства проявляет углерод в этой реакции?).
Карбид алюминия — светло-желтые прозрачные кристаллы. Вам более известен карбид кальция СаС2 в виде кусков серого цвета. Его применяют газосварщики для получения ацетилена:
СаС2 + 2Н20 = Са(ОН)2 + С2Н2
Ацетилен используют для резки и сварки металлов, сжигая его с помощью кислорода в специальных горелках.
Если водой подействовать на карбид алюминия, то получится другой газ — метан СН4:
Аl4C3 + 12Н20 = 4Аl(ОН)3 + ЗСН4
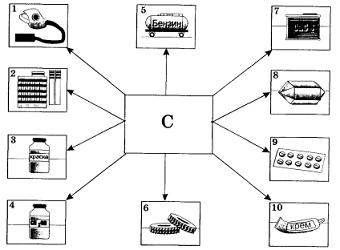 Рис. 42. Применение углерода (активированного угля, графита, сажи): 1 — адсорбент; 2 — в производстве сахара; 3 — для приготовления черной краски; 4 — для очистки спирта; 5 — в производстве синтетического бензина; 6 — наполнитель при получении резины; 7 — для получения карбида кальция; 8 — для получения искусственных алмазов; 9 — в медицине; 10 — составная часть крема для обуви Метан можно получить также синтезом из углерода и водорода при нагревании. Рис. 42. Применение углерода (активированного угля, графита, сажи): 1 — адсорбент; 2 — в производстве сахара; 3 — для приготовления черной краски; 4 — для очистки спирта; 5 — в производстве синтетического бензина; 6 — наполнитель при получении резины; 7 — для получения карбида кальция; 8 — для получения искусственных алмазов; 9 — в медицине; 10 — составная часть крема для обуви Метан можно получить также синтезом из углерода и водорода при нагревании.
Если в пробирке прокалить смесь черного порошка оксида меди(II) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди:
С + 2СuО = 2Сu + С02
(какие свойства проявляет углерод в этой реакции?).
Круговорот углерода в природе. В природе углерод встречается в свободном состоянии (алмаз, графит) и в форме соединений, главным образом карбонатов. Основным карбонатным минералом является кальцит СаС03, который образует известняк, мел и мрамор.
В атмосфере содержится оксид углерода С02 — углекислый газ. Это соединение образуется при дыхании живых организмов и при сгорании топлива. Поэтому в городской местности, вблизи заводов, фабрик и транспорта углекислого газа конечно же больше, чем в сельской местности. Он образуется также при тлении и гниении органических веществ.
Гораздо больше, чем в воздухе, углекислого газа содержится в водах морей и океанов.
Углерод — основная составная часть каменного угля (до 99% ), бурого угля (до 72% ), а также торфа (до 57% ). Теперь вам очевидно происхождение названия углерод, т. е. «рождающий уголь». Аналогично и латинское название карбонеум в основе содержит корень карбо — уголь.
Нефть является смесью соединений углерода, главным образом с водородом. Их так и называют — углеводороды. Понятно, что это в основном жидкие углеводороды. Однако в нефти растворены также газообразные и твердые углеводороды. Углеводороды являются главной составной частью природного газа.
Углерод — это особый химический элемент. Он основа многообразия органических соединений, из которых построены все живые организмы на нашей планете.
Все перечисленные источники углерода участвуют в круговороте его в природе (рис. 43). Из атмосферы и природных вод углекислый газ поглощается зелеными растениями (фотосинтез), а в результате процессов дыхания, брожения, гниения С02 снова поступает в атмосферу и воды морей и океанов. Добываемые из недр земли уголь, нефть и другие углеродсодер-жащие горючие ископаемые при сжигании выделяют С02, поступающий в атмосферу. При разрушении горных пород содержащиеся в них металлы при действии атмосферного С02 образуют осаждающиеся карбонаты.
Большие количества С02 выделяются при извержении вулканов.
1. Строение атома и степени окисления углерода —4, +4. 2. Аллотропия углерода: алмаз и графит. 3. Древесный и активированный уголь. 4. Адсорбция, ее применение. 5. Химические свойства углерода: взаимодействие с кислородом, металлами, с водородом, с оксидами металлов. 6. Карбиды кальция и алюминия. 7. Ацетилен и метан. 8. Круговорот углерода в природе.
Сравните строение алмаза и графита и их физические свойства — твердость, оптические свойства, электропроводность.
Напишите уравнения реакций с участием углерода, которые характеризуют отдельно его восстановительные и окислительные свойства. Рассмотрите окислительно-вос-становительные процессы для них.
Вспомните из курса биологии, какой период в истории Земли носит название каменноугольного или карбона. Каково происхождение каменного угля?
Почему в домашние холодильники рекомендуется помещать по нескольку таблеток карболена?
Напишите уравнения реакций взаимодействия угля с оксидом железа(III) и оксидом олова(IV). Рассмотрите окислительно-восстановительные процессы.
При сжигании 8 г угля было получено 10,64 л углекислого газа, что составляет 95% от теоретически возможного. Какова массовая доля примесей в угле?
При недостатке кислорода углерод взаимодействует с углекислым газом согласно уравнению:
С + С02 = 2СО
Какая форма существования элемента углерода проявляет в этой реакции окислительные свойства, а какая — восстановительные?
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С -> СаС2 -> С2Н2 -> С02 -> СО Рассмотрите окислительно-восстановительные процессы.
самопроверка по химии, кроссворды для 9 класса, <span style="text-decoration: underline;" />библиотека учебников Содержание урока  конспект урока конспект урока  опорный каркас опорный каркас  презентация урока презентация урока  акселеративные методы акселеративные методы  интерактивные технологии Практика интерактивные технологии Практика  задачи и упражнения задачи и упражнения  самопроверка самопроверка  практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты  домашние задания домашние задания  дискуссионные вопросы дискуссионные вопросы  риторические вопросы от учеников Иллюстрации риторические вопросы от учеников Иллюстрации  аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа  фотографии, картинки фотографии, картинки  графики, таблицы, схемы графики, таблицы, схемы  юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы  притчи, поговорки, кроссворды, цитаты Дополнения притчи, поговорки, кроссворды, цитаты Дополнения  рефераты рефераты  статьи статьи  фишки для любознательных фишки для любознательных  шпаргалки шпаргалки  учебники основные и дополнительные учебники основные и дополнительные  словарь терминов словарь терминов  прочие Совершенствование учебников и уроков прочие Совершенствование учебников и уроков  исправление ошибок в учебнике исправление ошибок в учебнике  обновление фрагмента в учебнике обновление фрагмента в учебнике  элементы новаторства на уроке элементы новаторства на уроке  замена устаревших знаний новыми Только для учителей замена устаревших знаний новыми Только для учителей  идеальные уроки идеальные уроки  календарный план на год календарный план на год  методические рекомендации методические рекомендации  программы программы  обсуждения Интегрированные уроки обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|














