|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Солі (середні), їх склад, назви. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміниСолі – кристалічні тверді речовини, які можна розглядати як продукти повного чи часткового заміщення йонів гідрогену кислоти металом або гідроксид-іонів основ. Гідроксосолі – являють собою результати неповного заміщення груп ОН-. Катіон – це позитивно заряджений йон. Аніон – це негативно заряджений йон. Дисоціація – це розклад частинки (молекули, радикала, йона) на декілька більш простих частинок. Кислотний залишок - група атомів, що залишається при відщепленні від молекули кислоти йонів Гідрогену. Хід урокуСутність солей, їх склад.Солі – кристалічні тверді речовини, які можна розглядати як продукти повного чи часткового заміщення йонів гідрогену кислоти металом або гідроксид-іонів основ (чи амфотерних гідроксидів) – кислотними залишками. Будь-яку сіль можна уявити як продукт взаємодії основи і кислоти, тобто реакції нейтралізації. Наприклад: KOH + HCl = KCl + H2O Залежно від складу розрізняють такі типи солей: середні, кислі (основи взято менше) та основні. Також виділяють подвійні, змішані та комплексні солі. Середні солі при дисоціації дають тільки катіони металу і аніони кислотного залишку. Вони виступають продуктом повного заміщення атомів водню відповідної кислоти на атоми металу. Мал. 1. Аніон і катіон. Кислі при дисоціації дають катіони металу, йони водню і аніони кислотного залишку. Вони є продуктом неповного заміщення атомів водню відповідної кислоти на атоми металу. Основні солі при дисоціації дають катіони металу, аніони кислотного залишку та йони ОН. Вони являються продуктом неповного заміщення груп ОН відповідної основи на кислотні залишки. Подвійні солі утворені двома катіоном та одним аніоном. Змішані солі утворені одним катіоном та двома аніонами. Комплексні солі утворені складним (комплексним) катіоном або аніоном. Щоденно солі зустрічаються у нашому житті. Яка ж з них найбільш популярна? Звісно, харчова. Так звана «йодована сіль». Щоб дізнатися більше про те, що ж вона являє собою насправді, пропонуємо вам переглянути наступне відео. Відео 1. Що таке «йодована сіль».
Контролюючий блок 1
Назви солейНазви солей утворюються з назви катіонів та аніонів з відповідними префіксами, із зазначенням в круглих дужках (при потребі) ступеня окиснення відповідного елемента: CrSO4 – хром (ІІ) сульфат, Мал. 2. Хром (ІІ) сульфат. Fe(NO3)3 – ферум (ІІІ) нітрат, Мал. 3. Ферум (ІІІ) нітрат. Na[Sb(OH)6] – натрій гексагідроксостибат (V), (NH4)2Cr2O7 – диамоній дихромат (VI). Для низки елементів (Sb, Bi, Ti, V, W, U) властиве утворення оксосолей за рахунок того, що їх гідроксосолі легко відщеплюють воду: BiCl3 + 2NaOH = Bi(OH)2Cl + 2NaCl або сумарно: BiCl3 + 2NaOH = BiOCl + 2NaCl + H2O Згідно з існуючою у даний час номенклатурою такі солі називають солями оксометалу: оксобісмут хлорид, оксотитан сульфат TiOSO4, діоксоуран сульфат UO2SO4 тощо. Найпоширеніші міжнародні назви солей: KNO3 — калій нітрат; Мал. 4. Калій нітрат. FeSO4 — ферум (ІІ) сульфат; Мал. 5. Ферум (ІІ) сульфат. Fe2(SO4)3 — ферум (ІІІ) сульфат; NaJ — натрій йодид; KCl — калій хлорид; Мал.6. Калій хлорид. Якщо вам цікаво як утворюється хлорид калію, то до вашої уваги наступне відео. Відео2. Утворення хлориду калію.
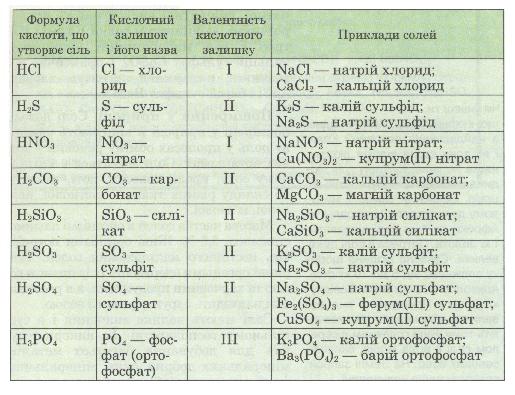
KHSO4 — калійгідроген сульфат; Cr(OH)2Cl — хром дигідроксохлорид; [Al(OH)2]2SO4 — дигідроксоалюміній (ІІІ) сульфат. Мал.7. Формули кислот й утворюваних ними солей. Контролюючий блок 2
Добування солейВирізняють декілька методів добування солей: 1) Взаємодія між кислотою й металом: 2HCl + Mg = MgCl2 + H2 Мал. 8. Магній хлорид. 2) Реакція нейтралізації: NaOH + HNO3 = NaNO3 + H2O 3) Реакція між основним або амфотерним оксидом і кислотою: Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 4) Взаємодія основ з кислотними оксидами: NaOH + CO2 = NaHCO3 5) Взаємодія основних оксидів із кислотними: CaO + SiO2 = CaSiO3 6) Взаємодія лугів із солями: 2KOH + CuCl2 = Cu(OH)2 + 2KCl 7) Реакція між сіллю й кислотою: AgNO3 + HCl = AgCl + HNO3 8) Реакція між двома солями: CdSO4 + (NH4)2S = CdS + (NH4)2SO4 9) Реакція безпосереднього сполучення металу з неметалами: Fe + S = FeS 10) Взаємодія кислот із солями: 2HCl + Na2CO3 = 2NaCl + HO + CO2 Щоб краще зрозуміти процес взаємодії солей та кислот, пропонуємо до вашої уваги наступне відео. Відео 3. Взаємодія кислот і солей.
11) Взаємодія металів із солями: Fe + CuSO4 = FeSO4 + Cu Контролюючий блок 3
Домашнє завдання
Цікаво знати, що…
Для одержання молока візьміть 2—3-процентні розчини натрій хлориду та розчин арґентум нітрату або розчини кальцій хлориду та натрій карбонату такої ж концентрації. Нерозчинні, у воді солі AgCl та CaCO3 надають рідинам вигляду «молока». Якщо нерозчинних сполук утворилося багато, то вони випадають з розчину в осад і це псує спробу. Для того, щоб повернути «молоко» знов у воду, в першу склянку додавайте потроху розчину натрій тіосульфату (Na2S2O3), а в другу розведеної хлоридної кислоти. При цьому відбуваються реакції, пов’язані з утворенням розчинних у воді безбарвних сполук. Список використаних джерел1. Урок на тему «Солі та їх місце у нашому житті» Садовського М.І., вчителя хімії, м. Львів, СШ №14.
Садовський М.І. Аблогіна Р.А. Горбатко С.М.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: