|
Гіпермаркет Знань>>Хімія>>Хімія 7 клас. Повні уроки>>Хімія: Поняття про періодичну систему хімічних елементів Д. І. Менделєєва.Повні уроки
Мета уроку1. Розповісти учням про наукові дослідження в області хімії Д.І. Менделєєва. Хід урокуДмитро Іванович Менделєєв
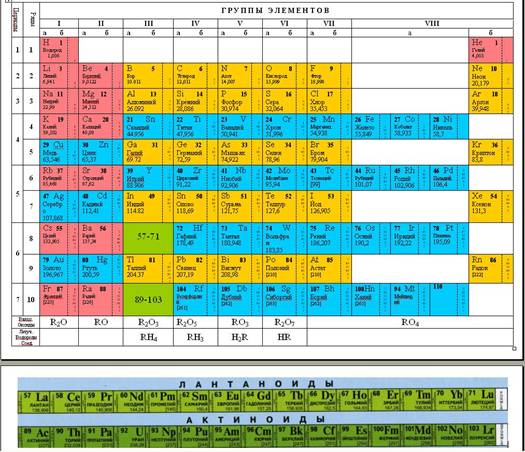
У 1870 році Д.І. Менделєєв в «Основах хімії» публікує другий варіант системи («Природну систему елементів»), що має для нас більш звичний вигляд: горизонтальні стовпці елементів-аналогів перетворилися на вісім вертикально розташованих груп; шість вертикальних стовпців першого варіанту перетворилися на періоди, що починалися лужним металом і що закінчуються галогеном. Кожен період був розбитий на два ряди; елементи різних рядів, що увійшли до групи, утворили підгрупи.
Поняття хімічного елементаСлово елемент (лат. elementum) використовувалося ще в античності (Цицероном, Овідієм, Горацієм) як частина чогось (елемент промови, елемент освіти і т. п.). У давнину була поширена вислів «Як слова складаються з букв, так і тіла - з елементів ». Звідси - ймовірне походження цього слова: за назвою ряду приголосних букв в латинському алфавіті: l, m, n, t («el» - «em» - «en» - «tum»). На міжнародному з'їзді хіміків у м. Карлсруе (Німеччина) в 1860 р. були прийняті визначення понять молекули й атома. Хімічний елемент (з точки зору атомно-молекулярного вчення) являє собою кожний окремий вид атомів. Сучасне визначення хімічного елемента:
З допомогою цифри, що стоїть попереду символу елемента, можна позначити число атомів або молей атомів даного елемента Приклади: Цифрами меншого розміру біля символу елемента позначаються: зліва вгорі - атомна маса, зліва внизу - порядковий номер, справа вгорі - заряд іона, справа внизу - число атомів у молекулі: Картка хімічного елемента:
Характеристика періодичної системи хімічних елементівСпецифіка першого періоду в тому, що він містить всього 2 елементи: H і He. Місце H в системі неоднозначно: оскільки він виявляє властивості, спільні з лужними металами і з галогенами, його поміщають або в Ia-, або (переважно) в VIIa-підгрупу. Гелій - перший представник VIIa-підгрупи (проте довгий час Не і всі інертні гази об'єднували в самостійну нульову групу).
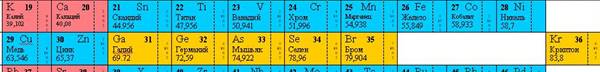
Третій період (Na - Ar) також містить 8 елементів, характер зміни властивостей яких багато в чому аналогічний що спостерігається в другому періоді. Однак Mg, на відміну від Be, більш металеві, так само як і Al у порівнянні з В, хоча Al властива амфотерність. Si, Р, S, Cl, Ar - типові неметали, але всі вони (крім Ar) проявляють вищі ступені окислення, рівні номеру групи. Таким чином, в обох періодах в міру збільшення Z спостерігається ослаблення металевого та посилення неметалевих характеру елементів. Менделєєв називав елементи другого і третього періодів (малих, за його термінологією) типовими. Істотно, що вони належать до числа найбільш поширених у природі, а С, N і O є поряд з H основними елементами органічної матерії (органогенних). Всі елементи перших трьох періодів входять до підгрупи а. Четвертий період (K - Kr) містить 18 елементів (перший великий період, за Менделєєву). Після лужного металу K і лужноземельного Ca (s-елементи) слід ряд з десяти так званих перехідних елементів (Sc - Zn), або d-елементів (символи дані синім кольором), які входять до підгрупи б відповідних груп Періодична система елементів Більшість перехідних елементів (всі вони метали ) проявляє вищі ступені окислення, рівні номеру групи. Виняток - тріада Fe - Co - Ni, де два останніх елемента максимально позитивно тривалентних, а залізо в певних умовах відомо в ступені окислення VI. Елементи, починаючи з Ga і закінчуючи Kr (р-елементи), належать до підгрупах а, і характер зміни їх властивостей такої ж, як і у відповідних інтервалах Z у елементів другого і третього періодів. Встановлено, що Kr здатний утворювати хімічні сполуки (головним чином з F), але ступінь окислення VIII для нього невідома. П'ятий період (Rb - Xe) побудований аналогічно четвертого, в ньому також є вставка з 10 перехідних елементів (Y - Cd), d-елементів. Специфічні особливості періоду: 1) у тріаді Ru - Rh - Pd тільки рутеній виявляє ступінь окислення VIII, 2) всі елементи підгруп а проявляють вищі ступені окислення, рівні номера групи, включаючи і Xe; 3) у I відзначаються слабкі металеві властивості. Таким чином, характер зміни властивостей у міру збільшення Z у елементів четвертого і п'ятого періодів більш складний, оскільки металеві властивості зберігаються у великому інтервалі порядкових номерів. Шостий період (Cs - Rn) включає 32 елемента. У ньому, крім 10 d-елементів (La, Hf - Hg) міститься сукупність з 14 f-елементів, лантаноїдів, від Ce до Lu (символи чорного кольору). Елементи від La до Lu хімічно дуже подібні. У короткій формі Періодична система елементів лантаноїди включаються в клітку La (оскільки їх переважна ступінь окиснення III) і записуються окремим рядком внизу таблиці. Цей прийом кілька незручний, оскільки 14 елементів виявляються як би поза таблиці. Подібного недоліку позбавлені довга і сходова форми Періодична система елементів, що добре відображають специфіку лантаноїдів на тлі цілісної структури Періодична система елементів Особливості періоду: 1) у тріаді Os - Ir - Pt тільки осмій проявляє ступінь окислення VIII, 2) At має більш виражений (у порівнянні з 1) металевий характер, 3) Rn, мабуть (його хімія мало вивчена), повинен бути найбільш реакційноздатними з інертних газів.
Контролюючий блок1. Розкажіть трохи про Д.І. Менделєєва Список використаних джерел
Горбатко С. М. Горбачевський А.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: