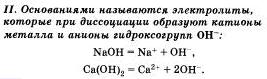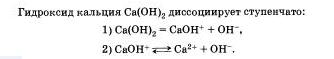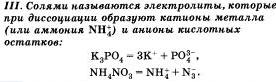|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Основные положения теории электролитической диссоциации Обобщим сведения об электролитической диссоциации в виде основных положений ныне общепризнанной теории. Они заключается в следующем.
В результате такого взаимодействия образуются гидратиро-ванные, то есть связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и не-гидратированные (в безводных солях).
Свойства гидратиронянных и негндратировашшх ионов отличаются, как вы смогли уже убедиться на примере ионов меди.
При растворении в воде электролиты диссоциируют (расспадаются) на положительные и отрицательные ионы.
Свойства ионов совершенно не похожи на свойства атомов, которые их образовали. Ионы — зто одна из форм существования химического элемента. Например, атомы металла натрия энергично взаимодействуют с водой, образуя при этом щелочь и водород Н, в то время как ионы натрия таких продуктов не образуют. Хлор имеет желто-зеленый цвет и резкий запих, ядовит, а ионы хлора — бесцветны, неядовиты, лишены запаха. Никому не придет в голову использовать в пищу металлический натрий и газообразный хлор, в то время как без хлорида натрия, состоящего из ионов натрия и хлора, невозможно приготовление пищи.
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду, и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду, и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов равна сумме зарядов анионов, вследствие чего растворы электролитов остаются электронейтральными.
Ионы — зто положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
Само слово «ион» в переводе с греческого означает "странствующий". В растворах ноны беспорядочно передвигаются («странствуют») в различных направлениях.
По составу воны делятся на простые и сложные.
2. Причиной диссоциации электролита вводных растворах является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
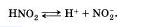
5. Не все электролиты в одинаковой мере диссоциируют на ионы.
Степень диссоциации зависит от природы электролита и его концентрации. По степени диссоциации электролиты делят на сильные и слабые.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
По характеру образующихся ионов различают три типа электролитов: кислоты, основания и соли.
7. Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка:

Следует учитывать, что диссоциация электролитов по второй ступени происходит намного слабее и равновесие сдвинуто влево. Диссоциация по третьей ступени при обычных условиях не происходят.
Все кислоты объединяет то. что они при диссоциации обязательно образуют катионы водорода. Поэтому логично предположить, что общие характерные свойства кислот — кислый вкус, изменение окраски индикаторов и др. — обусловлены именно катионами водорода.
Очевидно, что свойства солей определяются как катионами металла, так и анионами кислотного остатка. Так. соли аммония имеют как общие свойства, обусловленные ионами, так и специфические, обусловленные различными анионами. Аналогично, общие свойства сульфатов — солей серной кислоты — определяются ионами SO 2- 4+ , а различные — разными катионами. В отличие от многоосновных кислот и оснований, содержащих несколько гидроксид-нонов, такие соли, как К2S04, АlCl3 и т.д. диссоциируют сразу полностью, а не ступенчато.
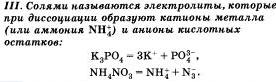
1. Основные положения теории электролитической диссоциации.
2. Ионы простые и Сложные, гндратированные и негидратированные, катионы и анионы.
3. Кислоты, основания и соли в свете теории электролитической диссоциации.

Напиши уравнения диссоциации следующих злектролитов: сульфита железа (III); карбоната калия: фосфата аммонии; нитрата меди (II): гидроксида бария; фосфорной кислоты. Дайте названия ионов.
Какие ил перечисленных ниже веществ будут диссоциировать: гидроксид железа, гидрокспд калия, кремниевая кислота, азотная кислота, оксид серы (IV). оксид кремния (IV), сульфид натрия, сульфид железа (II)? Почему? Запишите возможные уравнения диссоциации.
В записи уравнении ступенчатой диссоциации серной кислоты для первой ступени используют знак равенства, а для второй - знак обратимости. Почему?
словарь терминов по химии, фишки для любознательных, учебники для 8класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|