|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Основи, їх склад, назви. Повні уроки
Тема
Мета уроку
Задачі уроку
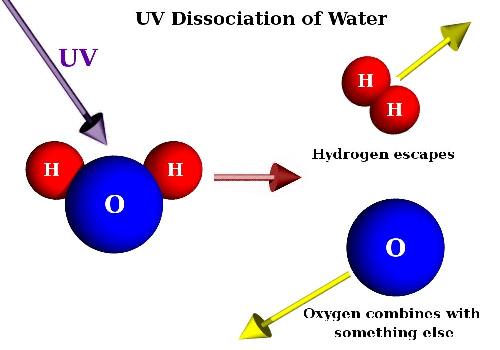
Основні терміниОснови – сполуки, молекули яких складаються з металу та гідроксидних груп — ОН. Катіон – це позитивно заряджений йон. Аніон – це негативно заряджений йон. Дисоціація – це розклад частинки (молекули, радикала, йона) на декілька більш простих частинок. Кислотний залишок - група атомів, що залишається при відщепленні від молекули кислоти йонів Гідрогену. Хід урокуСутність основ, їх склад.Основами називаються сполуки, молекули яких складаються з металу та гідроксидних груп — ОН. Основи – це складні сполуки, що складаються з катіона, та гідроксид-іона. Загальна формула – M(OH)x. З точки зору теорії електролітичної дисоціації, основи – це електроліти, які у водному розчині дисоціюють з утворенням лише одного типу аніонів – гідроксид-іонів. За здатністю до дисоціації основи називаються лугами. Мал.1 . Дисоціація води. Основи у воді дисоціюють на йони металу (амонію у випадку гідрату амоніаку) і гідроксид-йони. Жодних інших аніонів, крім гідроксид-йонів, основи не утворюють. Водні розчини лугів надають розчину лакмусу синього кольору, фенолфталеїну – малинового, метилоранжу – жовтого. Нерозчинні основи поділяються на амфотерні гідроксиди та основи. Кількість гідроксид-іонів, здатних заміщуватись на кислотні залишки, визначає кислотність основ та амфотерних гідроксидів. Тому вони можуть бути однокислотні, двокислотні, трикислотні, чотирикислотні. Мал. 2. Особливості розчинних і нерозчинних основ. Контролюючий блок 1
Назви основЗгідно з міжнародною номенклатурою назви основ складаються з назви катіона металу і слова гідроксид, вказуючи в дужках валентність катіона, якщо вона змінна, наприклад: NaOH — натрій гідроксид (їдкий натр); Мал. 3. Натрій гідроксид. KOH — калій гідроксид (їдкий калій); Мал. 4. Калій гідроксид. Ca(OH)2 — кальцій гідроксид (гашене вапно); Мал. 5. Кальцій гідроксид. Fe(OH)2 — ферум (ІІ) гідроксид; Fe(OH)3 — ферум (ІІІ) гідроксид. Якщо до складу сполуки входять інші йони, то в назві їх перелічують з відповідними числовими префіксами: CrO(OH) — хром оксисен гідроксид, Fe3O2(OH)5 — триферум диоксиген пентагідроксид. Контролюючий блок 2
Добування основМетоди добування гідроксидів: 1) Взаємодія активних металів з водою: 2Na + 2H2O = 2NaOH + H2 Взаємодію основи і води ви можете спостерігати на наступному відео. Відео 1. Взаємодія натрій гідроксиду і води.
2) Електроліз водних розчинів деяких солей: 2NaCl + 2H2O → H2 (катод) + Cl2 (анод) + 2NaOH (біля катода) 3) Взаємодія основних оксидів з водою: CaOH + H2O = Ca(OH)2 Na2O + H2O = 2NaOH Як відбувається описана вище реакція ви можете спостерігати на відео, зазначеному нижче. Відео 2. Взаємодія основних оксидів з кислотою.
4) Взаємодія солей з лугами: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Взаємодія солей з кислотами: Na[Al(OH)4] + HCl = NaCl + Al(OH)3 Контролюючий блок 3
Домашнє завдання
Цікаво знати, що…
Відомо, що хамелеон від подразнення чи зміни зовнішнього середовища змінює колір своєї шкіри. У хімії мінеральним «хамелеоном» називають метал марганець, сполуки якого залежно від умов реакції швидко змінюють своє забарвлення. Так, солі марганцю (ІІ) світло-рожевого кольору. Якщо ж до їх розчинів додати лугу, випадає білий осад манган (ІІ) гідроксиду, який на повітрі швидко буріє. Дослід 1. У хімічну склянку наливають розведений розчин будь-якої солі манган (ІІ), підкислюють його концентрованою HNO3, висипають невелику кількість коричневого PbO2 і нагрівають. При цьому майже безбарвний розчин стає фіалковим: 2MnO2+ + 5PbO2 + 4H+ = 2MnO4 + 5Pb2+ + 2H2O Дослід 2. У три склянки наливають фіалкового розчину ФОРМУЛА. У перший додають розведеної H2SO4, у другий – дистильованої води, а в третій – концентрованого розчину KOH. Потім у кожну склянку додають розчину K2SO3 або NaNO2. При цьому фіалкове забарвлення аніона MnO4 скрізь зникає, проте в першій склянці розчин знебарвлюється: 2MnO4 + 5SO3 + 6H+ = 2Mn2+ + 5SO4 + 3H2O у другій – випадає бурий осад: 2MnO4 + 3SO3 + 5H2O = 2Mn(OH)4↓ + 3SO4 + 2OH у третій – розчин вмить зеленіє: 2MnO4 + NO2 + 2OH = 2MnO4 + NO3 + H2O Дослід 3. Якщо висипати твердий залишок після прожарювання KMnO4 у воду, то спочатку утворюється розчин зеленого кольору, який швидко переходить у синьо-фіалковий, потім у фіалковий і, нарешті, у малиновий. Одночасно випадає бурий осад: 3MnO4 + 4H2O = 2MnO4 + Mn(OH)4↓ + 4OH 3Mn4 + 8H2O = 2MnO4 + 2Mn(OH)4↓ + 8OH Список використаних джерел1. Урок на тему «Основи, їх сутність та характеристика» Іванченко О.І., вчителя хімії, м. Київ, СШ №134.
Іванченко О.І. Левченко В.А. Горбатко С.М
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: