|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Метан. Молекулярна, електронна і структурна формули метану, поширення у природі
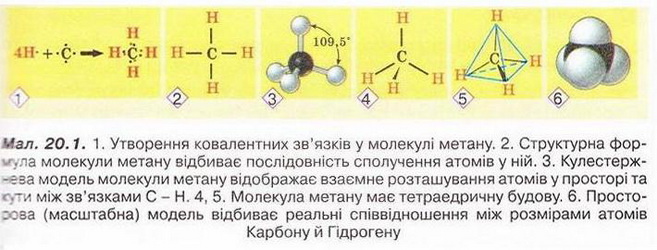
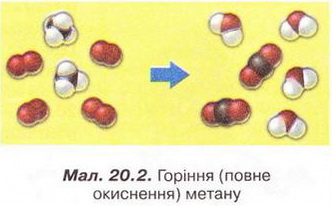
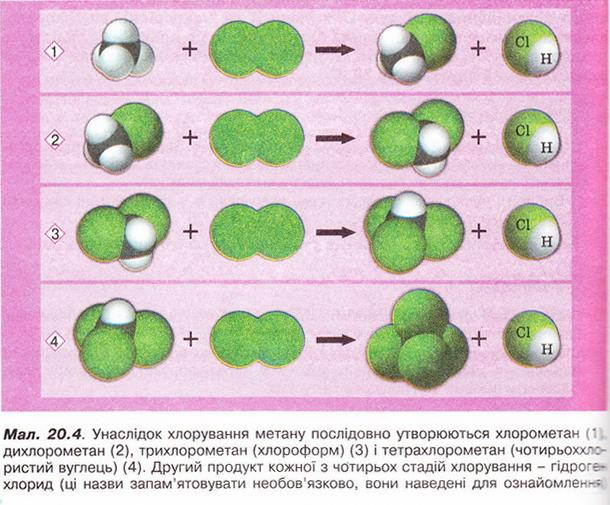
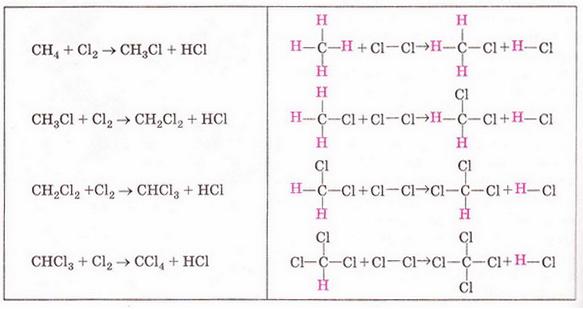
Метан Після опрацювання § 20 ви зможете: складати молекулярну, електронну та структурну формули метану, пояснювати їх; збирати моделі молекули метану; характеризувати склад, структуру, фізичні властивості метану; ілюструвати його властивості рівнянням,* хімічних реакцій; наводити приклади застосування метану; обґрунтовувати застосування метану його властивостями та вплив продуктів синтетично" хімії на довкілля за їх неправильного використання; дотримуватись правил безпечного поводження з метаном. На шляху до успіху пригадаємо з вивчених курсів природничих наук та основ здоров'я: які моделі використовують в органічній хімії; як записують молекулярні електронні та структурні формули речовин; яка середня молярна маса повітря; у який спосіб обчислюють відносну густину одного газу за іншим скільки валентних електронів у атомі Карбону в збудженому стані; що таке гідрати; які правила користування паливними газами; чим небезпечний парниковий ефект; що таке енергія активації й тепловий ефект хімічної реакції. • Молекулярна, електронна і структурна формули метану, як ви вже знаєте з попереднього параграфа, - знакові моделі, за допомогою яких унаочнюють склад і будову молекули цієї найпростішої органічної сполуки. Завдання Метан - найпростіша летка сполука Карбону з Гідрогеном. Користуючись періодичною системою, визначте молекулярну формулу метану. Усно обчисліть його молярну масу, масові частки елементів у сполуці та відносну густину за воднем і киснем. Визначте, легший чи важчий метан за повітря. Ви пересвідчилися, що до складу молекули метану входить один атом Карбону і чотири атоми Гідрогену. З огляду на будову зовнішнього енергетичного рівня атома Карбону в збудженому стані змоделюймо утворення ковалентних зв'язків у молекулі метану (мал. 20.1,1). В електронній формулі метану замінімо спільні електронні пари атомів Карбону й Гідрогену рисочками, аби одержати структурну формулу сполуки мал. 20.1,2). Розгляньмо кулестержневу (мал. 20.1,3) й масштабну моделі молекул метану (мал. 20.1,6). Вони, так само як електронна і структурна формули, відображають структуру та принцип будови цього мікрооб'єкта, хоча й не відтворюють його зовнішнього вигляду. В утворенні ковалентних зв'язків з атомами Гідрогену беруть участь один s- і три р-електрони атома Карбону. Однак у молекулі метану всі зв'язки рівноцінні, атоми Гідрогену розташовані симетрично по кутах тетраедра. У центрі цієї геометричної фігури розташований атом Карбону мал. 20.1, 4, 5). Причина такого взаєморозташування полягає у вирівнюванні за формою та енергією електронних орбіталей зовнішнього енергетичного рівня атома Карбону. Ковалентні зв'язки між атомами Карбону й Гідрогену слабо полярні. Однак молекула метану, з огляду на її симетричність, неполярна. Завдання Поміркуйте й висловіть припущення щодо розчинності метану у воді та інших полярних розчинниках. • Поширення метану в природі деякою мірою відоме вам з курсу фізичної географії України. Цей безбарвний, без запаху і смаку газ - чи не головна складова природного і важливий компонент попутного нафтового газів. Залежно від родовища об'ємна частка метану в природному газі становить від 75 до 99 %. Завдання Назвіть перспективні нафтогазоносні райони України і покажіть їх на карті. Чимало метану в складі копального газу міститься у кам'яно-вугільних пластах, трапляється він і у сольових копальнях. Вибухи суміші метану з киснем повітря часто спричиняють масову загибель шахтарів. Цікаво? У позаминулому столітті в сольовій копальні «Камера Спалена», що в горі Величка (Польща), були робітники, яких називали «грішниками, що каються». Вони надягали мокрий одяг з каптурами і повзали шахтами. Тримаючи в руці довгі ціпки, на кінці яких жевріли смолоскипи. У такий спосіб вони випалювали метан під стелею, не дозволяючи його концентрації сягнути критичної межі. Пізнавально! Виходи метану на земну поверхню трапляються в сейсмоактивних місцевостях, у місцях розломів земної кори, на дні океану тощо. Чимало метану утворюється внаслідок анаеробного бродіння рослинних решток у болотах, річковому мулі, під час перетравлювання їжі великою рогатою худобою. Біогаз – продукт переробки фекалій і сміття – також переважно складається з метану. Цікаво? Болотний газ хімічними методами вперше дослідив у 1776р. італійський природодослідник Алессандро Вольта і встановив його відмінність від водню. Також це природне джерело метану вивчали Бертолле, Дальтон, Берцеліус тощо. Болотний газ у неглибокій замуленій водоймі збирали в такий спосіб. Товстостінну склянку або пляшку занурювали у воду, аби вона заповнилася рідиною, потім повертали її догори дном, вставляли лійку і збирали метан, розпушуючи дно за допомогою ціпка. Коли в склянці збирався газ, її закорковували під водою й після цього виймали на поверхню. Завдання Поясніть, які фізичні властивості метану зумовили можливість збирати його витісненням води та витісненням повітря. Неабиякі запаси метану «законсервовано» у твердих газових гідратах: у порожнинах кристалічних ґраток льоду містяться молекули метану. Завдання Поміркуйте й висловіть припущення щодо температури й тиску. За яких могли б утворитися тверді газові гідрати. Де, на вашу думку, ймовірне існування таких покладів? Трапляється метан і у Всесвіті. Його виявлено в атмосфері планет Юпітер, Сатурн, Уран і Нептун. Величезні озера рідкого метану є на поверхні Титана, найбільшого з природних супутників Сатурна. З курсу географії вам відомо, що природний газ належить до невідновних паливних ресурсів, його поклади вичерпні. Тому альтернативні джерела метану (біопаливо) набувають неабиякого значення. Водночас слід зважати на те, що ця найпростіша органічна речовина належить до так званих парникових газів. Величезні обсяги метану надходять в атмосферу з рисових полів, боліт, тваринних ферм тощо. Науковці стверджують, що це не лише сприяє глобальному потеплінню, а й виснажує озоновий шар планети. •Хімічні властивості метану зумовлені складом і будовою його молекули, її неполярний характер, міцність ковалентних зв'язків С-Н зумовлюють хімічну стійкість метану до розчинів кислот і лугів. Метан не знебарвлює фіолетовий розчин калій перманганату, тобто стійкий до окиснення. Як і переважна більшість органічних сполук, метан - горюча речовина. Цей газ використовують як екологічно чисте паливо в побуті, промисловості та на транспорті. Реакція повного окиснення метану добре відома вам з повсякденного життя. Описуючи її на макрорівні, ви, напевно, звернули б увагу на характерний блакитний колір полум'я та виділення великої кількості теплоти. На мікрорівні процес горіння метану в кисні змодельований на малюнку 20.2. Завдання 1. За малюнком 20.2 запишіть термохімічне рівняння. Зважте на те, що в органічній хімії між лівою і правою частинами рівняння ставлять знак «→», а не «=». Поясніть, чим складене рівняння відрізняється від малюнка. 2. Виберіть число, яке дорівнює сумі коефіцієнтів у лівій частині хімічного рівняння повного окиснення метану: А 2; Б 3; В 4; Г 6. Пам'ятайте! З повітрям метан утворює вибухонебезпечні суміші. Завдання У помешканні ви відчули слабкий запах побутового газу. Виберіть правильні варіанти дій та їхню послідовність: У молекулі метану атом Карбону не має на зовнішньому енергетичному рівні неспарених електронів. Усі його валентні електрони беруть участь з утворенні ковалентних зв'язків із чотирма атомами Гідрогену. Тому до молекули метану неможливе приєднання атомів Гідрогену, галогенів тощо. Тобто метан - насичений вуглеводень. Натомість за певних умов метан вступає в реакції заміщення. Приміром, реакцію метану з хлором ініціює освітлення. Під час хлорування відбувається послідовне заміщення атомів Гідрогену в молекулі метану на атоми Хлору, змодельоване на малюнку 20.4. Унаслідок цього утворюється суміш хлорометану (мал. 20.3,1 і 20.4,1), дихлорометану (мал. 20.4,2), трихлорометану та тетрахлорометану (мал. 20.4,4). їх розділяють дистиляцією. Другий продукт кожної з чотирьох стадій хлорування - гідроген хлорид. Завдання За малюнком 20.4 запишіть хімічні рівняння кожної стадії хлорування метану, використовуючи: а) молекулярні; б) повні структурні формули реагентів і продуктів реакції. Продукти хлорування метану використовують не лише як розчинники. Хлороформ має яскраво виражену анестезуючу дію, тому раніше його застосовували в медицині для знеболювання. Цікаво? 1831 р. хлороформ незалежно один від одного добули Саму ель Гутрі, Юстус Лібіх і Ежен Суберейн. Хімічну формулу встановив французький хімік Дюма і 1834 р. запропонував назву «хлороформ». 1847 р. акушер Джеймс Симпсон уперше використав хлороформ для загального наркозу під час приймання пологів. Пізнавально! Тетрахлорометан - продукт повного заміщення атомів Гідрогену в молекулі метану на атоми Хлору - не горить. Тому тривалий час його використовували під час гасіння пожеж адже важка пара цієї речовини пере-криває доступ повітря й горіння миттєво припиняється. Проте гасіння полум'я техрахлорометаном може супроводжуватися утворенням дуже струйного газу фосгену СОСІ2. Тому гасити вогонь у закритих приміщеннях тетрахлорометаном можна тільки з відповідними пересторогами. Усі продукти хлорування метану - токсичні речовини, до того ж сприяють руйнуванню озонового шару. • Застосування метану зумовлене його хімічними властивостями. Передусім метан використовують як паливо та сировину для добування неорганічних і органічних речовин (мал. 20.5). Про інші сполуки Карбону - і корисні, і небезпечні - йтиметься в наступних параграфах. Стисло про головне До складу молекули метану входить один атом Карбону і чотири атоми Гідрогену. Молекулярна формула метану СН4, його молярна маса 16 г/моль, масова частка Карбону в метані - 75 %. Відносна густина метану за воднем - 8, за киснем - 0,5. Метан - безбарвний газ без смаку і запаху. Він малорозчинний у воді, майже вдвічі легший за повітря, тому його можна збирати витісненням і води, і повітря. Метан - чи не головна складова природного і важливий компонент покутного нафтового газів. Перспективні нафтогазоносні райони України -Західноукраїнський регіон, Дніпровсько-Донецька западина, Причорноморсько-Кримська нафтогазоносна область. Метан утворюється внаслідок анаеробного бродіння рослинних решток, переробки фекалій і сміття. Перспективне джерело метану - газогідрати. Молекула метану має тетраедричну будову, вона неполярна. Метан стійкий до дії розчинів кислот і лугів та окиснення (не знебарвлює фіолетовий розчин калій перманганату). Метан - горюча речовина, вступає в реакцію повного окиснення: СН4 + 202 → С02 + 2Н20; ΔН < 0 Ця реакція екзотермічна. З повітрям метан утворює вибухонебезпечні суміші. Тому під час використання побутового газу слід бути дуже обережними! У молекулі метану атом Карбону не має на зовнішньому енергетичному рівні неспарених електронів. Тому до молекули метану неможливе приєднання атомів Гідрогену, галогенів тощо. Метан - насичений вуглеводень. Натомість за певних умов метан вступає в реакції заміщення. Реакцію метану з хлором ініціює освітлення: Метан використовують як паливо та сировину для добування неорганічних і органічних речовин. Продукти хлорування метану переважно використовують як розчинники та реагенти в органічному синтезі. Застосуйте свої знання й уміння 1.Виберіть молекулярну формулу метану: 2.Виберіть форму молекули метану: 3.Поясніть, чому метан називають блакитним паливом. 4.До побутового газу добавляють метилмеркаптан - речовину з характерним неприємним запахом; а) поясніть, для чого потрібна ця добавка; б) *запишіть повну (див. § 19) структурну формулу метилмеркаптану за йог: спрощеною структурною формулою \SН 5. Виберіть характеристику реакції повного окиснення метану: 6. Метан, що виходив з газовідвідної трубки, підпалили (мал. 20.6,1), трубку занурили в посудину з хлором (мал. 20.6,2). Поясніть, чому жовто-зелене забарвлення хлору поступово зникає (мал. 20.6,3), а під час наближення посудини з концентрованим водним розчином амоніаку з'являється (мал. 20.6,4) «дим без вогню» (пригадайте, ви спостерігали це явище під час вивчення хімії у 7-му класі). 7. Наведіть щонайменш по дві причини того, чому: а) медики припинили використання хлороформу для анестезії; б) вогнегасники, заряджені тетра-хлорометаном, практично вийшли з ужитку. 8. Дев'ятикласники Антін і Тамара посперечалися. Антін стверджував, що метан - перспективне паливо для двигунів майбутнього, які полегшать процес освоєння космосу й уможливлять міжпланетні польоти. Тамара заперечувала: запаси метану на Землі швидко вичерпуються, тож перспективи не такі вже й райдужні... Долучіться до їхньої дискусії, аргументуйте свою думку. 9. Оцініть вірогідність повідомлення ЗМІ: «Метан традиційно транспортують трубопроводами або в балонах. Група науковців під керівництвом професора Ендрю Купера з університету Ліверпуля виявила, що газуватий метан можна акумулювати в суміші дрібнодисперсного кварцу й води. До комерціалізації розробки ще дуже далеко, тим паче до її масового застосування. Але перші кроки, безсумнівно, зроблено». Аргументуйте свою думку. 10. Установіть відповідність між хімічними реакціями і застосуванням метану:
Скарбничка досвіду 1. Зберіть масштабну модель молекули метану. Спочатку виготовте зі світлого пластиліну чотири кульки діаметром 31 мм - моделі атомів Гідрогену. Потім частину кожної кульки зріжте на висоті 18,7 мм. З темного пластиліну виготовте кульку діаметром 48,5 мм. На кульці зробіть чотири рівновіддалених по кутах тетраедра позначки для з'єднувальних стержнів. З боку позначок зробіть зрізи на висоті 31 мм. У центри зрізів уставте невеликі сірникові палички, на які надіньте моделі атомів Гідрогену. Підготуйте план складання моделі цієї молекули. 2. Дізнайтеся використовуючи різноманітні джерела інформації, про який свій винахід і з якого приводу Гемфрі Деві писав: «Найвищою винагородою за мої роботи буде усвідомлення того, що я зробив добро мені подібним». Підготуйте повідомлення про цей винахід.
Г. А. Лашевська, Геометрія, 9 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: