|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Кремний и его соединения
Второй представитель элементов главной подгруппы IV группы — кремний Si.
В природе кремний — второй по распространенности после кислорода химический элемент. Земная кора более чем на четверть состоит из его соединений. Наиболее распространенным соединением кремния является его диоксид SiO2, другое его название — кремнезем. В природе он образует минерал кварц (рис. 46) и многие разновидности, такие, как горный хрусталь и его знаменитая лиловая форма — аметист, а также агат, опал, яшма, халцедон, сердолик, которые известны как поделочные и полудрагоценные камни. Диоксид кремния — это также обычный и кварцевый песок.
Из разновидностей минералов на основе диоксида кремния — кремня, халцедона и других первобытные люди изготовляли орудия труда. Именно кремень, этот невзрачный и не очень прочный камень, положил начало каменному веку — веку кремневых орудий труда. Причин этому две: распространенность и доступность кремня, а также его способность образовывать при сколе острые режущие края.
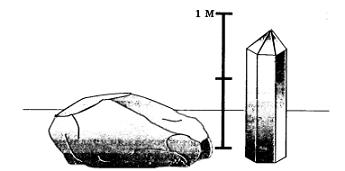
Рис. 46. Природный кристалл кварца (слева) и выращенный искусственно (справа)
Второй тип природных соединений кремния — это силикаты. Среди них наиболее распространены алюмосиликаты (понятно, что эти силикаты содержат алюминий). К алюмосиликатам относятся гранит, различные виды глин, слюды. Силикатом, не содержащим алюминий, является, например, асбест.
Важнейшее соединение кремния — оксид SiO2 необходим для жизни растений и животных. Он придает прочность стеблям растений и защитным покровам животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
Кремний придает гладкость и прочность костям человека.
Кремний входит и в состав низших живых организмов — диатомовых водорослей и радиолярий, — нежнейших комочков живой материи, которые создают свои непревзойденные по красоте скелеты из кремнезема.
Свойства кремния. Если вы пользуетесь микрокалькулятором с солнечной батарейкой, то, вероятно, имеете представление о кристаллическом кремнии. Это полупроводник. В отличие от металлов с повышением температуры его электропроводность увеличивается. На спутниках, космических кораблях и станциях устанавливают солнечные батареи, преобразующие солнечную энергию в электрическую. В них работают кристаллы полупроводников, и в первую очередь кремния.
Кремниевые фотоэлементы могут превратить в электрическую до 10% поглощенной солнечной энергии.
Кремний горит в кислороде, образуя известный уже вам диоксид кремния, или оксид кремния(1У):
Si+ 02 = SiO2
Будучи неметаллом, при нагревании он соединяется с металлами с образованием силицидов, например:
Si + 2Mg = Мg2 Si
Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния — силан:
Мg2 Si + 2Н2SO4 = 2MgSO4 + SiH4
В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды:
SiH4 + 202 = SiO2 + 2Н2О
Повышенная реакционная способность силана по сравнению с метаном СН4 объясняется тем, что у кремния больше размер атома, чем у углерода, поэтому химические связи —Н слабее связей С—Н.
Кремний взаимодействует с концентрированными водными растворами щелочей, образуя силикаты и водород:
Si + 2NаОН + Н20 = Na2SiО3 + 2Н2
Кремний получают, восстанавливая его из диоксида магнием или углеродом.
Оксид кремния(IV), или диоксид кремния, или кремнезем, как и С02, является кислотным оксидом. Однако в отличие от С02 имеет не молекулярную, а атомную кристаллическую решетку. Поэтому SiO2 твердое и тугоплавкое вещество. Он не растворяется в воде и кислотах, кроме, как вы знаете, плавиковой, но взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты — силикатов.
Силикаты можно получить также сплавлением диоксида кремния с оксидами металлов или с карбонатами:
SiO2 + СаО = СаSiO3
SiO2 + СаС03 = СаSiO3 + С02
Силикаты натрия и калия называют растворимым стеклом. Их водные растворы — это хорошо известный силикатный клей.
Из растворов силикатов действием на них более сильных кислот — соляной, серной, уксусной и даже угольной получается кремниевая кислота Н2SiO3:
К2SiO3 + 2НСl = 2КСl + Н2SiO3
Следовательно, Н2SiO3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объем раствора, превращая его в полутвердую массу, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество — силикагелъ, широко применяемый в качестве адсорбента — поглотителя других веществ.
Применение кремния. Вы уже знаете, что кремний применяют для получения полупроводниковых материалов, а также кислотоупорных сплавов. При сплавлении кварцевого песка с углем при высоких температурах образуется карбид кремния SiC, который по твердости уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней.
Из расплавленного кварца изготавливают различную кварцевую химическую посуду, которая может выдерживать высокую температуру и не трескается при резком охлаждении.
Соединения кремния служат основой для производства стекла и цемента.
Обычное оконное стекло имеет состав, который можно выразить формулой
Nа20 • СаО • 6SiO2
Его получают в специальных стекловаренных печах сплавлением смеси соды, известняка и песка.
Отличительная особенность стекла — способность размягчаться и в расплавленном состоянии принимать любую форму, которая сохраняется при застывании стекла. На этом основано производство посуды и других изделий из стекла.
Стекло — одно из древнейших изобретений человечества. Уже 3—4 тыс. лет назад производство стекла было развито в Египте, Сирии, Финикии и Причерноморье. Высокого совершенства в стеклоделии достигли мастера Древнего Рима. Они умели получить цветные стекла и делать из кусочков такого стекла мозаики.

Стекло — это материал не только ремесленников, но и художников. Произведения искусства из стекла являются обязательными атрибутами любого крупного музея. А цветные витражи церквей, мозаичные панно — яркие тому примеры. В одном из помещений Санкт-Петербургского отделения Российской Академии наук находится мозаичный портрет Петра I, выполненный М. В. Ломоносовым.
Дополнительные качества стеклу придают различные добавки. Так, введением оксида свинца получают хрустальное стекло, оксид хрома окрашивает стекло в зеленый цвет, оксид кобальта — в синий и т. д.
Области применения стекла очень обширны. Это оконное, бутылочное, ламповое, зеркальное стекло; стекло оптическое — от стекол очков до стекол фотокамер; линзы бесчисленных оптических приборов — от микроскопов до телескопов.
Другой важный материал, получаемый на основе соединения кремния, — цемент. Его получают спеканием глины и известняка в специальных вращающихся печах. Если порошок цемента смешать с водой, то образуется цементное тесто, или, как его называют строители, «раствор», который постепенно затвердевает. При добавлении к цементу песка или щебня в качестве наполнителя получают бетон. Прочность бетона возрастает, если в него вводится железный каркас, — получается железобетон, из которого готовят стеновые панели, блоки перекрытий, фермы мостов и т. д.
Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Открытие кремния. Хотя уже в глубокой древности люди широко использовали в своем быту соединения кремния, сам кремний в элементарном состоянии был впервые получен в 1825 г. шведским химиком Й. Я. Берцелиусом. Однако за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнен примесями.
Латинское название силициум берет свое начало от лат. силекс — кремень. Русское название «кремний» происходит от греч. кремнос — утес, скала.
1. Природные соединения кремния: кремнезем, кварц и его разновидности, силикаты, алюмосиликаты, асбест.
2. Биологическое значение кремния.
3. Свойства кремния: полупроводниковые, взаимодействие с кислородом, металлами, щелочами.
4. Силан.
5. Оксид кремния(IV). Его строение и свойства: взаимодействие со щелочами, основными оксидами, карбонатами и магнием.
6. Кремниевая кислота и ее соли. Растворимое стекло.
7. Применение кремния и его соединений.
8. Стекло.
9. Цемент.
Укажите сходство и различие оксида углерода(IV) и оксида кремния(IV) по строению и свойствам (взаимодействие с водой, щелочами, основными оксидами и магнием). Напишите уравнения реакций.
Почему углерод называют основным элементом живой природы, а кремний — основным элементом неживой природы?
При взаимодействии избытка раствора гидроксида натрия с 16 г кремния было получено 22,4 л водорода. Какова массовая доля кремния во взятом образце? Сколько граммов оксида кремния содержалось в нем? Сколько граммов 60%-ного раствора щелочи потребовалось для реакции?
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) SiO2 ->Si -> Са2Si -> SiH4 -> SiO2 -> Si
б) Si -> SiO2 -> Nа2SiO3 -> Н2SiO3 -> SiO2 -> Si
Рассмотрите процессы окисления-восстановления.
Знаменитый ученый в области минералогии А. Е. Ферсман писал: «Показывают самые разнообразные предметы: прозрачный шар, сверкающий на солнце чистотой холодной ключевой воды, красивый, пестрого рисунка агат, яркой игры многоцветный опал, чистый песок на берегу моря, тонкую, как шелковинка, нитку из плавленого кварца или жароупорную посуду из него, красиво ограненные груды горного хрусталя, таинственный рисунок фантастической яшмы, окаменелое дерево, превращенное в камень, грубо обработанный наконечник стрелы древнего человека... все это одно и то же соединение...» Какое? Закончите цитату.
М. В. Ломоносов в письме на имя И. И. Шувалова «О пользе стекла» писал:
Далече до конца Стеклу достойных хвал, На кои целый год едва бы мне достал.
Докажите справедливость утверждения великого ученого.
картинки к уроку химии, акселеративные методы для всех классов, учебные пособия, книги, учебники
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












