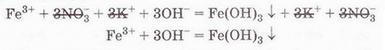|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Йонні рівняння
ЙОННІ РІВНЯННЯ • Йонні рівняння, записані у скороченій формі, відбивають сутьхімічної реакції. Ви пересвідчилися в цьому, виконуючи лабораторні досліди. Також ви навчилися використовувати таблицю «Розчинність кислот, основ і солей у воді» (див. додаток) для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів, записувати рівняння реакцій у повній і скороченій йонних формах. Закріпімо ці знання й уміння, виконавши зворотне завдання: доберімо пари речовин, взаємодію між якими у розчині описує скорочене йонне рівняння. Приміром, взаємодія у розчині катіонів Феруму(III) та гідроксид-аніонів веде до утворення бурого драглистого осаду ферум(ІІІ) гідроксиду (мал. 12.5): Які саме речовини треба взяти для проведення цієї реакції? Звернімося до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток), аби з’ясувати, які сполуки Феруму(ІІІ) розчинні у воді. Розчинними є хлорид, бромід, сульфат і нітрат Феруму(ІІІ). Аналогічно доберімо розчинну основу. Можна використати розчини гідроксидів Калію, Натрію, Барію тощо. Єдине обмеження – другий продукт реакції має бути розчинним. Тож умові завдання не відповідатиме взаємодія у розчині ферум(ІІІ) сульфату з барій гідроксидом. Адже барій сульфат також нерозчинний. І хоча реакція відбудеться, але жоден йон у повному йонному рівнянні не скоротиться (пересвідчіться у цьому, склавши повне йонне рівняння). Аби перевірити наші передбачення, запишімо у повній та скороченій йонних формах рівняння реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині:
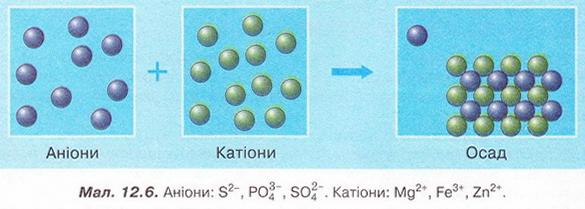
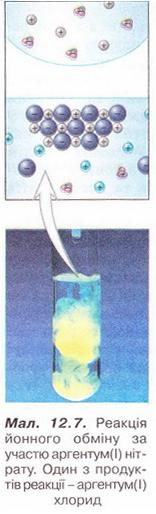
Завдання Виберіть пари речовин, взаємодії яких у розчині відповідає скорочене йонне рівняння: A Na2SO3 і HCl; Б Ag2SO3 і HCl; В Na2SO4 і HCl; Г K2SO3 і H2SO4; Д ZnSO3 і H2SO4. Стисло про головне Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинах солей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями. Йонними рівняннями можуть бути зображені будь-які реакції, що збуваються за участю електролітів у розчинах. Якщо вони не супроводжуються зміною зарядів йонів (не змінюються ступені окиснення елементів), то їх називають реакціями йонного обміну. Аби скласти рівняння реакції у йонній формі, зважають на те, що електроліти у розчині дисоціюють на йони. За таблицею «Розчинність кислот, основ і солей у воді» (див. додаток) визначають, які з-поміж реагентів є сильними електролітами. їхні формули записують у йонній формі. Визначають, які з цих йонів взаємодіятимуть між собою з огляду на знаки їхніх зарядів. Електростатичні сили зумовлюватимуть притягування різнойменних і відштовхування однойменно заряджених іонів. Продукти реакції, які є сильними електролітами, записують у йонній формі. Формули слабких електролітів і газуватих речовин, які залишають сферу реакції, записують традиційно. У повній йонній формі рівнянь коефіцієнти перед формулами кожного з йонів визначають з урахуванням індексів у формулах електролітів та коефіцієнтів перед ними. Аби одержати скорочене йонне рівняння, формули йонів, які не беруть участі у реакції, у лівій й правій частинах повного йонного рівняння скорочують. Скорочене йонне рівняння відбиває суть реакції обміну між електролітами у розчині. Воно показує, які йони взаємодіють і яка речовина є продуктом реакції. Для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів використовують таблицю «Розчинність кислот, основ і солей у воді». Застосуйте свої знання й уміння 1. Запишіть у повній і скороченій йонних формах рівняння реакцій між: 2. Виберіть пару йонів, яка бере участь у хімічній реакції між магній сульфатом і барій нітратом у розчині: 3. Виберіть пару йонів, яка бере участь у хімічній реакції між калій гідроксидом і нітратною кислотою у розчині: 4. Доберіть не менше двох пар речовин, реакції між якими у розчині зумовлені взаємодією: 5. Виберіть пари йонів, які не можуть одночасно перебувати у розчині: 6. Роздивіться малюнок 12.6. Виберіть пари йонів, які відповідають схематичному зображенню скороченого йонного рівняння. 7. На малюнку 12.7 на мікро- і макрорівні зображено реакцію йонного обміну за участю аргентум(І) нітрату. Один з її продуктів - аргентум(І) хлорид. Визначте, як електроліти могли б бути другим реагентом у цій реакції. Складіть хімічні рівняння, запишіть їх у повній і скороченій йонній формах. 8. У хімічний стакан із розчином сульфатної кислоти занурили електроди приладу для дослідження електропровідності й увімкнули електричний струм. Де досліджуваного розчину почали повільно доливати розчин барій гідроксиду. Спрогнозуйте зміни, які відбуватимуться у розчині та з індикатором приладу Поясніть спостереження за допомогою повних і скорочених йонних рівнянь. 9. До складу начинки карамельок «Шипучка» входить питна сода (натрій гідрогенкарбонат NaНС03) та лимонна кислота. Поясніть, чому ці речовини починають взаємодіяти між собою лише під час контакту з вологою. Скарбничка досвіду 1. У хімічному кабінеті під керівництвом учителя хімії визначте кислотність виданих зразків меду. Виготовте розчини з масовою часткою меду 10%. У хімічні стакани відмірте порції 10 %-ного водного розчину меду об'ємами по 100мл, добавте до кожної з них по 5 крапель 1 %-ного спиртового розчину, фенолфталеїну й по порції 0,1 %-ного розчину натрій гідроксиду об'ємом 5 МЛ. Поясніть, у якому випадку мед має підвищену кислотність: якщо розчин залишився безбарвним, чи за появи малинового забарвлення. Відповідь аргументуйте рівнянням реакції, запишіть його у повній і скороченій йонних формах. 2. Поміркуйте, яку широко застосовану у кулінарії сполуку можна використати у домашніх умовах для виявлення надмірної кислотності меду. Складіть план експерименту й обговоріть його з учителем хімії. Виконайте дослід у домашніх умовах. 3. Дізнайтеся, використовуючи різноманітні джерела інформації, про застосування йонного обміну для опріснення води.
Г. А. Лашевська, Хімія, 9 клас
Планування з хімії, підручники та книги онлайн, курси та завдання з хімії для 9 класу
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: