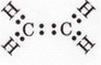|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Етилен. Молекулярні, електронні та структурні формули, фiзичні властивості. Хімічні властивості
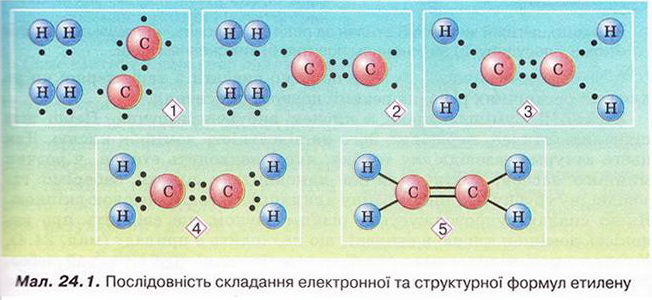
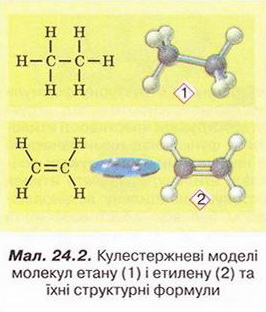
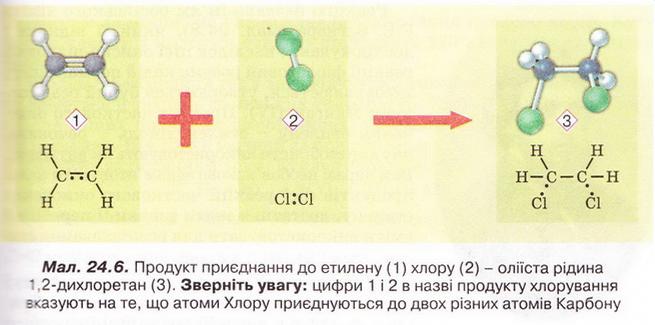
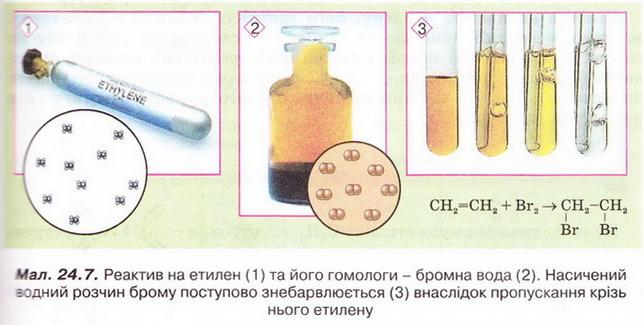
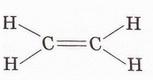
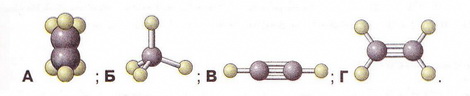
Етилен Після опрацювання § 24 ви зможете складати й пояснювати молекулярну, електронну та структурну формули етилену; збирати моделі молекули етилену; характеризувати склад, структуру, фізичні та хімічні властивості етилену; ілюструвати властивості етилену рівняннями хімічних реакцій; розрізняти за функціональними ознаками ненасичені вуглеводні й порівнювати їх з насиченими; розв'язувати розрахункові задачі вивчених типів на прикладі етилену; визначати етилен дослідним шляхом; наводити приклади застосування етилену; встановлювати причинно-наслідкові зв'язки між складом, будовою, властивостями та біологічними функціями і застосуванням етилену; обґрунтовувати застосування етилену його властивостями, роль етилену в живих організмах. На шляху до успіху пригадаємо з вивчених курсів хімії та біології: які речовини називають вуглеводнями; яка валентність Карбону в органічних сполуках; що таке гомологи і гомологічна різниця; як і чому змінюється характер горіння вуглеводнів у гомологічному ряду метану; чому лужні метали, галогени, луги не трапляються в природі; чим зумовлена низька реакційна здатність метану та його гомологів; як пов'язані кількість, маса та об'єм газуватих речовин; чому метан - насичений вуглеводень; що таке каталізатор; які хімічні реакції характерні для метану та його гомологів; як рослини борються за виживання. • Молекулярна, електронна та структурна формули етилену (у сумісній науковій хімічній літературі вам траплятиметься й інша назва цієї сполуки - етен) - знакові моделі, за допомогою яких унаочнюють склад і будову молекули цієї органічної сполуки. Розгляньмо їх докладніще. За молекулярною формулою етилену С2Н4 легко встановити його приналежність до вуглеводнів. Пригадаймо, Гідроген - одновалентній хімічний елемент, а Карбон в органічних сполуках чотирьохвалентний. Як сполучити між собою два атоми Карбону і чотири атоми Гідрогену аби не порушити цієї умови? Єдиний правильний варіант зображено на малюнку 24.1. На зовнішньому енергетичному рівні атома Гідрогену міститься один неспарений електрон. Атом Карбону у збудженому стані містить на зовнішньому енергетичному рівні чотири неспарені електрони (мал. 24.1,1). На утворенні подвійного зв'язку між атомами Карбону кожен з них витрачає по два електрони (мал. 24.1,2). Ще по два неспарені електрони атоми Карбону можуть використати на утворення зв'язки із атомами Гідрогену (мал. 24.1,3). Пам'ятаймо, що кожна спільна електронна пара - ковалентний зв'язок. Замінивши в електронній формулі (мал. 24.1,4) етилену спільні пари електронів рисочками, дістанемо структурну формулу (мал. 24.1,5) цієї сполуки. Отже, у молекулі етилену атоми Карбону сполучені подвійним зв'язком, це унеможливлює обертання навколо нього. Кути між зв'язками в молекулі етилену становлять 120° вона має площинну будову (мал. 24.2, 2). Ви, напевно, звернули увагу, що молекулу етилену можна уявити як молекулу етану, у якій від кожного атома Карбону відщеплено по одному атому Гідрогену. Внаслідок цього між атомами Карбону виникає подвійний зв'язок. Завдання Порівняйте за малюнком 24.2 склад і будову етилену та етану. Поясніть, чи можна вважати етан гомологом етилену. Пригадайте, що таке гомологічна, різниця і складіть молекулярні формули двох наступних за етиленом членів гомологічного ряду. Висловіть припущення, який суфікс має бути в назвав гомологів етилену. • Фізичні властивості етилену зумовлені складом і будовою його молекул сили притягання між якими дуже слабкі. Етилен - безбарвні газ з ледь відчутним солодкуватим запахом. Він зріджується и твердне за низьких температур. Етилен малорозчинний у воді та інших поляри розчинниках, натомість добре розчиняється у вуглеводнях. Завдання Визначте легший чи важчий етилен за повітря. Поясніть, чи доцільно збирай етилен у посудину: а) витісненням повітря; б) витісненням води. • Хімічні властивості етилену почнімо вивчати з характерної чи для всіх не для всіх органічних речовин реакції повного окиснення. УВАГА!!! Суміш етилену з киснем вибухонебезпечна. Перш ніж підпалити етилен, перевірмо його на відсутність домішок кисню. Для цього занурмо газовідвідну трубку, якою надходить етилен у розчин мийного засобу. Коли склянка наповниться піною, заберімо газовідвідну трубку й підпалімо піну в склянці довгою палаючою скіпкою. Якщо спалах супроводжується різким звуком, це свідчить про наявність домішок кисню в етилені, що надходить з приладу (мал. 24.4). У такому разі підпалювати газ біля газовідвідної трубки вкрай небезпечно. Зачекаймо, доки струмінь етилену не витіснить усе повітря з приладу для добування газу, й повторімо перевірку на чистоту. Етилен горить кіптявим полум'ям: С2Н4 + 02 → С02 + Н20; ΔН < 0. Завдання Перетворіть схему реакції горіння етилену на хімічне рівняння. За його коефіцієнтами визначте співвідношення між об'ємами етилену і кисню, за якого їхня суміш вибухонебезпечна. Завдання Не здійснюючи обчислень, порівняйте масові частки Карбону в етані та етилені. Висловіть обґрунтоване припущення, який з двох вуглеводнів за тих самих умов горітиме більш кіптявим полум'ям. Запропонуйте спосіб зменшення кількості кіптяви під час згоряння вуглеводнів. Саме кіптявий характер полум'я та слабкий запах етилену привернув увагу німецького хіміка й лікаря Йоганна Йоахима Бехера (мал. 24.3). 1669 р. він вперше добув етилен дією нагрітої титрованої сульфатної кислоти на етиловий (винний) спирт. Цей спосіб добування етилену в лабораторії актуальний і донині (мал. 24.4): Завдання Окрім етилену й води, внаслідок нагрівання етилового спирту з концентрованою сульфатною кислотою утворюється низка побічних продуктів, зокрема карбон(IV) оксид і сульфур(IV) оксид. Поміркуйте й поясніть, для чого добутий етилен пропускають крізь суміш кальцій гідроксиду і натрій гідроксиду або крізь концентровану сульфатну кислоту та концентрований розчин натрій гідроксиду. Свої висновки обґрунтуйте за допомогою хімічних рівнянь. Своїм відкриттям Бехер не надто переймався, тож не обтяжив себе пошуками назви для добутого газу, який ще понад сто років потому називали «повітрям Бехера». У той самий спосіб 1795 р. голландські хіміки Дейман, Поте ван Тростовік, Бонд і Лауверенбург добули етилен, дослідили та описали його властивості. Науковці встановили приналежність синтезованої сполуки до вуглеводнів (пригадайте, як визначають склад органічних речовин). Вони виявили, що продукт хлорування етилену - оліїста рідина. Тому назвали цей газ олієродним - французькою «defiant». Згодом олефінами назвали гомологи етилену, сучасна назва цього гомологічного ряду - алкени. Будову етилену - а саме послідовність зв'язків між атомами Карбону й Гідрогену в його молекулі - встановив 1860 p. О.М. Бутлеров. Чотири роки потому Еміль Ерленмейєр (мал. 24.5, 1) висунув ідею про подвійний зв'язок між атомами Карбону в молекулі етилену й запропонував позначати її двома рисочками. Було виявлено, що, на відміну від гомологів метану, етилен досить реакційноздатна сполука. Характерними для нього є реакції приєднання за місцем подвійного зв'язку. Продукт приєднання до етилену водню (гідрування) - насичений вуглеводень етан: Каталізатори реакції гідрування - платина і нікель. Унаслідок хлорування етилену руйнується один зі зв'язків між атомами Карбону й до кожного з них приєднується по одному атому Хлору (мал. 24.6). 1,2-дихлоретан - безбарвна летка рідина зі специфічним запахом, майже негорюча, отруйна. Добре розчиняє жири, смоли, віск тощо. Її токсичні властивості використовують у сільському господарстві для боротьби з філоксерою на виноградниках, а також для знезаражування зерносховищ. На реакції приєднання брому ґрунтується якісна реакція на етилен. Зовнішній ефект цієї реакції (мал. 24.7) - знебарвлення бурого водного розчину брому - так званої бромної води (пригадайте, про її виготовлення йшлося в § 6). Завдання Використовуючи електронні формули (див. мал. 24.6), запишіть рівняння реакції приєднання брому до етилену й назвіть продукт реакції. Ще одна якісна реакція на подвійний зв'язок у молекулі етилену пов'язана з його здатністю легко окиснюватися, зокрема водним розчином калій перманганату. Водний розчин калій перманганату - реактив на сполуки з подвійним зв'язком С=С. Фіолетовий розчин калій перманганату внаслідок взаємодії з етиленом або його гомологами поступово знебарвлюється. Реакцію названо ім'ям російського хіміка Є.Є. Вагнера (мал. 24.8), який її відкрив і досліджував. Унаслідок цієї окисно-відновної реакції фіолетовий розчин калій перманганату знебарвлюється, утворюється бурий осад сполуки Мангану(IV). Продукт часткового окиснення етилену - етиленгліколь - речовина, яку автомобілісти використовують як антифриз. Вам наразі необов'язково запам'ятовувати назви продуктів цієї реакції часткового окиснення етилену, достатньо знати ознаки її перебігу й уміти використовувати для розпізнавання етилену та інших сполук з подвійним зв'язком С=С. • Етилен у природі, на відміну від метану і його гомологів, майже не трапляється. Причина полягає у високій реакційній здатності цієї сполуки. Незначні кількості етилену є у вулканічних газах, також він утворюється в тканинах рослин і тварин як проміжний продукт обміну речовин. • Застосування етилену як речовини, за допомогою якої регулюють достигання деяких овочів і фруктів під час їхнього зберігання і транспортування, ґрунтується на його особливій властивості. Етилен - фітогормон, він сприяє дозріванню плодів і спричиняє опадання листків рослин. Найактивніше етилен виробляють зрізані квіти та плоди в період дозрівання. Банани, приміром, виділяють значну кількість етилену й швидко достигають. Аби вони не перезріли й не втратили товарного вигляду, їх збирають ще зеленими і транспортують за температури не вище 13,5 °С. Якщо температура буде вищою, посилиться виділення етилену й банани набудуть коричневого кольору. Як регулятори швидкості достигання зручні у використанні сполуки, які легко розкладаються з виділенням етилену, зокрема етрел. Хімічна активність етилену, його здатність легко окиснюватися вступати в реакції приєднання зумовила застосування цього газу як сировини для синтезу найрізноманітніших органічних речовин. Чи не найважливішою поміж них є добре відомий вам з повсякденного життя поліетилен. Про цю та інші подібні до нього речовини йтиметься 2 наступному параграфі. Стисло про головне Молекулярна формула етилену С2Н4, електронна - Етилен - безбарвний газ з ледь відчутним солодкуватим запахом. Він занижується й твердне за низьких температур. Етилен малорозчинний у воді та інших полярних розчинниках, натомість добре розчиняється у вуглеводнях. Він трохи легший за повітря, тож доцільніше збирати його у посудину витісненням води. Етилен горить кіптявим полум'ям: С2Н4 +302 → 2С02 + 2Н20; ΔН < 0 Суміш етилену з киснем в об'ємних співвідношеннях 1 : 3 вибухонебезпечна. У лабораторії етилен добувають дією нагрітої концентрованої сульфатної кислоти на етиловий (винний) спирт. У промисловості етилен шаржують шляхом переробки нафти. Етилен досить реакційноздатна сполука. Характерними для нього є реакції приєднання водню, галогенів тощо за місцем подвійного зв'язку. На реакції приєднання брому ґрунтується якісна реакція на етилен. Зовнішній ефект цієї реакції - знебарвлення бурого водного розчину брому - так званої бромної води. Ще одна якісна реакція на подвійний зв'язок у молекулі етилену пов'язана з його здатністю легко окиснюватися, зокрема водним розчином калій перманганату, який унаслідок реакції знебарвлюється. Етилен через високу реакційну здатність у природі майже не трапляється. Як фітогормон він сприяє дозріванню плодів і спричиняє опадання листків рослин. Застосуйте свої знання й уміння 1. Виберіть модель молекули етилену: 2. Виберіть загальну кількість ковалентних зв'язків у молекулі етилену: 3. Установіть відповідність між відносною густиною етилену за певним газом та її числовими значеннями.
4. Виберіть суму коефіцієнтів у лівій частині рівняння реакції горіння етилену: 5. Виберіть характеристики реакції повного окиснення етилену: 6. Виберіть продукти повного окиснення етилену: 7. Виберіть суму коефіцієнтів у лівій частині рівняння реакції гідрування етилену: 8. Виберіть реактиви, за допомогою яких виявляють етилен: 9. Обчисліть об'єм: а) кисню, який витратився на спалювання етилену, якщо внаслідок цього утворився вуглекислий газ об'ємом 28 л; б) водню, який: витратиться на гідрування етилену об'ємом 400 л, та об'єм продукту реакції;І в) хлору, витраченого на хлорування етилену об'ємом 48 л (об'єм газуватих реагентів і продуктів реакцій виміряно за однакових умов). 10. Виберіть правильне твердження. Унаслідок хлорування етилену руйнується: 11. Квіти й фрукти на полотнах митців милують око й вражають свіжістю, Однак у повсякденному житті таке сусідство недоцільне - квіти швидше в'януть, плоди жовтіють, стають зморшкуватими. Поясніть причину цього явища. 12. Задля збільшення терміну зберігання овочів і фруктів у холодильнику виробники пропонують споживачам спеціальну тару та пакетики-саше. Покриття стінок контейнерів містить калій перманганат у суміші з глиною, ця ж суміш входить до складу гранул пакетиків. Як ви вважаєте, чи відповідають ці товари своєму призначенню? Поясніть, чому. Скарбничка досвіду Дізнайтеся, використовуючи різноманітні джерела інформації: • чому вусики пасифлори починають вигинатися, якщо поблизу розташоване яблуко; За результатами дослідження підготуйте презентацію.
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: