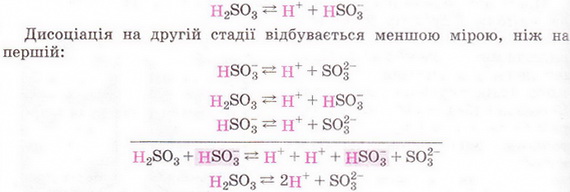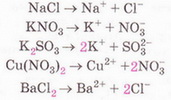|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Електролітична дисоціація кислот, основ, солей у водних розчинах ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ КИСЛОТ, ОСНОВ, СОЛЕЙ У ВОДНИХ РОЗЧИНАХ
Електролітична дисоціація кислот, основ, солей у водних розчинах
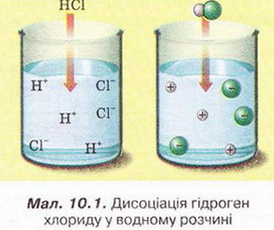
• Дисоціація електролітів у водних розчинахВода_–_найпоширеніша_речова_на_Землі._Здатність_води_розчиняти_інші_речовини._Розчини_у_природі_та_побуті,_приготування_розчинів.дає підстави класифікувати кислоти, основи, солі за видами йонів, які утворюються внаслідок нього процесу. Розгляньмо, на які саме йони дисоціюють кислоти, основи, ні, й сформулюймо їхні визначення з погляду електролітичної дисоціації. Кислотами називають електроліти, внаслідок дисоціації яких не утворюються жодні інші катіони, крім гідратованих йонів Гідрогену. Приміром, молекули гідроген хлориду у водному розчині дисоціюють катіони Гідрогену й хлорид-аніони (мал. 10.1). Тобто хлоридна кислота містить не молекули гідроген хлориду, а гідратовані йони: катіони Гідрогену й аніони Хлору. Спрощено (без відображення гідратації йонів) цей процес, описує рівняння електролітичної дисоціації: НСl →Н+ + Сl- Обчислімо у цьому рівнянні суму зарядів катіонів Гідрогену та аніонів Хлору. Варто запам'ятати, що у правильно складеному рівнянні електролітичної дисоціації сума зарядів усіх катіонів і аніонів дорівнює нулю. Завдання Щоразу перевіряйте, чи правильно складено рівняння електролітичної дисоціації, наведені у параграфі. Зверніть увагу: у цьому записі замість знака «=» використано стрілку. У такий спосіб зазначають, що електроліт дисоціює практично повністю. Так само повністю дисоціює у водному розчині сульфатна кислота.
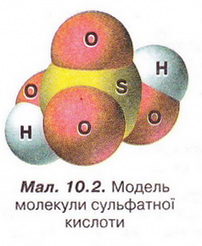
Н2S04 → 2Н+ + SО2-4 Зверніть увагу: індекс біля атома Гідрогену у формулі сульфатної кислоти і коефіцієнт перед катіоном Гідрогену у рівнянні її електролітичної дисоціації збігаються. У записах зарядів йонів, на відміну від ступенів окиснення, знак «+» або «-» ставлять після цифри. Основність кислоти визначають за кількістю катіонів Гідрогену, які утворюються в результаті дисоціації однієї молекули кислоти. Завдання За наведеними рівняннями електролітичної дисоціації визначте основність хлоридної та сульфатної кислот. Зауважимо, що багатоосновні кислоти дисоціюють ступінчасто. Приміром, на першій стадії дисоціації сульфітної кислоти легко відщеплюється перший катіон Гідрогену: Кислотні залишки різні у різних кислот. Спільною ознакою усіх кислот є наявність у їхніх розчинах гідратованих катіонів Гідрогену. Саме вони зумовлюють загальну властивість цих сполук - кислий смак. Ви, звичайно, пам'ятаєте, що кислоти у розчині виявляють за допомогою індикаторів. З огляду на те, що у розчинах усіх кислот містяться гідратовані катіони Гідрогену, можна дійти висновку, що саме вони зумовлюють зміну забарвлення індикаторів. Аби виявити катіони Гідрогену у розчині, виконаємо лабораторний дослід. ЛАБОРАТОРНИЙ ДОСЛІД Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ № 1(а). Виявлення йонів Гідрогену у розчині Завдання. Дослідіть, як діють розчини кислот на індикатори. Запишіть рівняння електролітичної дисоціації кислот. Визначте, який з індикаторів не використовують для виявлення йонів Гідрогену в розчині. Обладнання: штатив з пробірками або пластина із заглибинами. Реактиви: розчини сульфатної кислоти, лакмусу, метилового оранжевого, фенолфталеїну; розбавлена хлоридна кислота, універсальний індикаторний папір. Інструкція 1. У 4 пробірки або заглибини пластини внесіть по 5 крапель хлоридної кислоти. До першої проби хлоридної кислоти добавте краплю розчину лакмусу, до другої - метилового оранжевого, до третьої фенолфталеїну, четверту випробуйте шматочком універсального індикаторного паперу. Як змінюється забарвлення індикаторів під дією хлоридної кислоти? 2. Тепер проробіть те саме з розчином сульфатної кислоти. Що спостерігаєте? Які йони в розчинах кислот зумовлюють зміну забарвлення індикаторів? Який індикатор не можна використати для виявлення йонів Гідрогену в розчині? Завдання Встановіть відповідність між індикаторами та їхнім забарвленням у розчинах кислот
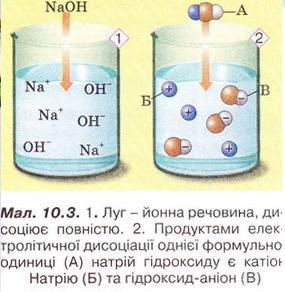
Ви уточнили свої уявлення про кислоти з огляду на характер їхньої електролітичної дисоціації, набули уміння виявляти у водному розчині катіони Гідрогену. Тепер розгляньмо електролітичну дисоціацію лугів. Лугами називають електроліти, які у водному розчині дисоціюють із утворенням гідратованих гідроксид-аніонів. Жодних інших негативних йонів під час цього процесу не утворюється. • Луги - йонні речовини, тому їхня дисоціація (мал. 10.3) є повною: Зверніть увагу на індекси у формулах лугів і коефіцієнти перед гідроксид-іонами у рівняннях електролітичної дисоціації. Катіони у складі різних лугів різні. Спільною ознакою усіх лугів є наявність у їхніх розчинах гідроксид-аніонів. Виконаймо лабораторний дослід з виявлення цих йонів у розчині.
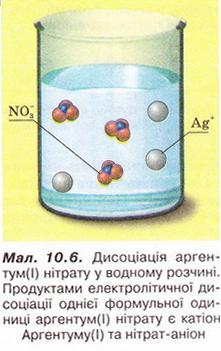
Завдання 1.Назвіть гідратовані йони у розчинах лугів, які, на вашу думку, зумовлюють загальні властивості цих сполук: милкість на дотик, руйнівну дію на шкіру, папір, волосся тощо. Щойно ви навчилися за допомогою індикаторів визначати катіони Гідрогену та гідроксид-аніони у розчинах. Чи не найзручніше використовувати для цього універсальний індикаторний папір. Порівнявши його забарвлення у досліджуваному розчині зі шкалою-еталоном, можна визначити показник рН. • Показник рН* (вимовляють «пе-аш») добре відомий вам з повідомлень ЗМІ, рекламних роликів, інструкцій до побутових товарів тощо. Він пов'язаний із концентрацією у розчині йонів Гідрогену та гідроксид-іонів. Приміром, у дистильованій воді об'ємом 1 л містяться катіони Гідрогену та гідроксид-аніони кількістю лише по 1·10-7 (тобто 0,000 000 1) моль. Оскільки вміст катіонів Гідрогену та гідроксид-аніонів однаковий, то середовище нейтральне. Не деталізуючи, зауважимо: рН нейтрального середовища дорівнює семи. Якщо рН < 7 - середовище кисле. рН > 7 відповідає лужному середовищу (мал. 10.4). Завдання За малюнком 10.4, 2 визначте колір соку червонокачанної капусти у: а) сильно кислому; б) нейтральному; в) сильно лужному середовищах. Поясніть, чи можна вважати сік червонокачанної капусти кислотно-лужним індикатором. Для визначення рН рідин (природні води, молоко, косметичні лосьйони, кров, шлунковий сік, стічні води, технологічні розчини тощо) у сучасних лабораторіях використовують електронні прилади - рН-метри (мал. 10.5). У досліджувану рідину занурюють скляний електрод, заряд якого залежить від середовища розчину. Прилад визначає заряд електрода й показує рН досліджуваного розчину. • Солями14._Солі_(середні),_їх_склад,_назвиназивають електроліти, які у водних розчинах дисоціюють на гідратовані катіони металічних елементів і аніони кислотних залишків. Солі - йонні речовини, тому їхня дисоціація є повною. Приміром, аргентум(І) нітрат у водному розчині дисоціює з утворенням катіонів Аргентуму(І) та нітрат-аніонів (мал. 10.6). Розгляньмо приклади дисоціації солей: Зверніть увагу на позначені кольором індекси у формулах солей і коефіцієнти перед відповідними йонами у рівняннях електролітичної дисоціації, порівняйте їх. Завдання 1. Визначте число нітрат-іонів у рівнянні електролітичної дисоціації алюміній нітрату: 2. Визначте число катіонів Калію у рівнянні електролітичної дисоціації калій ортофосфату: Стисло про головне Дисоціація електролітів у водних розчинах дає підстави класифікувати кислоти, основи, солі за видами йонів, які утворюються внаслідок цього процесу. Кислотні залишки різні у різних кислот. Спільною ознакою усіх кислот є наявність у їхніх розчинах гідратованих катіонів Гідрогену, які зумовлюють загальні властивості цих сполук. Лугами називають електроліти, які у водному розчині дисоціюють із утворенням гідратованих гідроксид-аніонів. Жодних інших негативних йонів під час цього процесу не утворюється. Луги - йонні речовини, тому їхня дисоціація є повною. Катіони у різних лугів різні, спільною ознакою усіх лугів є наявність у їхніх розчинах гідроксид-аніонів. Катіони Гідрогену та гідроксид-аніони у розчинах виявляють за допомогою індикаторів. З концентрацією у розчині йонів Гідрогену та гідроксид-іонів пов'язаний показник рН. рН нейтрального середовища дорівнює семи. Якщо рН < 7 – середовище кисле. рН > 7 відповідає лужному середовищу. Для точного означення рН рідин використовують електронні прилади - рН-метри. Процес дисоціації електролітів у водному розчині спрощено (без відображення гідратації йонів) описує рівняння електролітичної дисоціації. Застосуйте свої знання й уміння 1. Установіть відповідність між класами неорганічних сполук і визначеннями.
2. Визначте кількість нітрат-іонів у рівнянні електролітичної дисоціації кальцій нітрату: А1;БЗ;В6;Г9. 3. Визначте суму коефіцієнтів у правій частині рівняння електролітичної дисоціації калій ортофосфату: А1;Б2;ВЗ;Г4. 4. У водному розчині засобу для прочищення засмічених каналізаційних труб «Кріт» фенолфталеїн набуває малинового забарвлення: а) виберіть йони, які зумовлюють зміну кольору індикатора: А Н+; Б Na+; В ОН-; Г Сl-. б) *виберіть рН цього розчину: А рН = 7; Б рН < 7; В рН > 7; Г рН < 0. 5. У водному розчині засобу «Туалетне каченя» універсальний індикаторний папір набуває червоного забарвлення: а) виберіть йони, які зумовлюють зміну кольору індикатора: А Н+; Б Са2+; В ОН-; Г Сl-. б) *виберіть рН цього розчину: А рН = 7; Б рН < 7; В рН > 7; Г рН < 0. 6. Із чотирьох атомів Гідрогену, які входять до складу молекули оцтової кислоти СН3СООН, тільки один здатний у водному розчині відщеплятися у вигляді катіона Н+. Визначте основність оцтової кислоти. 7. Проаналізуйте йонний склад, зазначений на етикетках мінеральних вод. Складіть хімічні формули речовин, які зумовлюють його внаслідок електролітичної дисоціації. 8. У кристалізатор з водою пінцетом обережно помістили шматочок натрію розміром з горошину. Після закінчення хімічної реакції у добутий розчин занурили електроди приладу для вимірювання електропровідності, а) Опишіть перебіг реакції та запишіть її хімічне рівняння. Чи проводитиме розчин одного з її продуктів (якого саме?) електричний струм? Поясніть, чому, б) *Який рН добутого розчину? Як це можна довести експериментально? 9. Газуватий продукт реакції кристалічного натрій хлориду з концентрованою сульфатною кислотою розчинили у воді, а) Як називають цей розчин? Чи проводитиме він електричний струм? Поясніть, чому, б) *Який рН добутого розчину? Як це можна довести експериментально? Скарбничка досвіду Дослідіть на наявність йонів Гідрогену та гідроксид-іонів рідкі мийні засоби, столовий оцет, розчини питної соди, прального порошку, свіже молоко та кисломолочні продукти, косметичні лосьйони тощо. Для проведення домашнього досліду виготовте індикаторний папір із будь-якого пористого паперу побутового призначення та соку овочів, фруктів - бурякового, гранатового, червоного винограду тощо. Як індикатор можна використати розчин смородинового варення, відвар червонокачанної капусти або червоного буряка. Надзвичайно просто виготовити розчин індикатора з одноразового пакетика фруктового чаю (він містить подрібнені шматочки фруктів і пелюстки квіток).
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: