|
Гіпермаркет Знань>>Хімія>>Хімія 7 клас>> Добування кисню в лабораторії. Реакція розкладу. Поняття про каталізатор
Добування кисню в лабораторії. У лабораторних умовах кисень добувають розкладанням деяких оксигеновмісних речовин.
Дослід 1. Якщо зібрати прилад, як показано на мал. 62, і в пробірці нагрівати калій перманганат КMnО4 (побутова назва марганцівка), то в циліндрі над водою почне одразу ж збиратися кисень, витискаючи з циліндра воду.

Мал. 62. Добування кисню з калій перманганату.
Який висновок про фізичні властивості кисню можна зробити з цих спостережень?
Спостереження показують, що за стандартних умов кисень являє собою газ, який не має ні кольору, ні запаху. Він погано розчиняється у воді, оскільки витискує воду з циліндра.
Що ж відбулося в пробірці? Під впливом нагрівання калій перманганат КМnО4 розклався на три нові речовини: калій манганат К2МnО4, манган(ІV) оксид МnlО2 і кисень О2:
2КМnO4 = К2МnO4 + МnO2 + O2
Такі реакції належать до реакцій розкладу.
Хімічні реакції, під час яких з однієї речовини утворюються дві або більше нових речовин, називаються реакціями розкладу.
Поняття про каталізатор. Не всі оксигеновмісні речовини під час нагрівання швидко розкладаються з виділенням кисню. У такому випадку, щоб прискорити реакцію, використовують каталізатор. Наприклад, манган(ІV) оксид МnO2 прискорює розкладання гідроген пероксиду Н2O2:
2Н2O2 = 2Н2O + O2 ^
Переконаємось у цьому на досліді.
Дослід 2. Якщо до гідроген пероксиду Н2O2 в пробірці (мал. 63) добавити щіпку чорного порошку МnO2, то відразу ж відбувається бурхлива реакція з виділенням кисню. Кисень збирається в посудину за способом витіснення повітря.
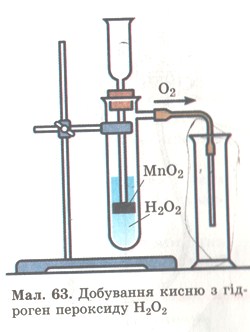
Мал. 63. Добування кисню з гідроген пероксиду.
А як довести, що в посудині справді кисень, а не повітря? З курсу природознавства ти знаєш, що довести це можна за допомогою тліючої скіпки. В кисні вона спалахує, а на повітрі — жевріє.
Якщо тепер профільтрувати утворену в досліді 2 суміш, то можна відокремити манган(ІV) оксид МnO2 і знову помістити його в пробірку з новою порцією гідроген пероксиду Н2O2. Ефект буде такий самий. Дослід можна повторювати знову і знову. Що це засвідчує? Це засвідчує, що манган(ІV) оксид МnO2 зберігає свою властивість прискорювати розкладання гідроген пероксиду Н2O2. При цьому він не витрачається і до складу продуктів реакції не входить. Такі речовини називаються каталізаторами.
Каталізатори — це речовини, які змінюють швидкість хімічної реакції, але не входять до складу її продуктів.
Каталізатори широко використовуються у промисловості. Вони дають змогу підвищувати продуктивність хімічних процесів, отже, економічніше вести виробництво.
Фізичні властивості кисню. Тепер узагальни свої спостереження і зроби висновок про деякі фізичні властивості кисню, а про інші дізнайся з підручника чи хімічного довідника.
За стандартних умов кисень — це безбарвний газ, без запаху і смаку, малорозчинний у воді (у 100 об'ємах води розчиняється 3 об'єми кисню), трохи важчий за повітря. У зрідженому стані кисень — рухлива рідина блакитного кольору.
Фізіологічна дія. Атмосферний кисень життєво важливий для всіх організмів (за винятком анаеробів). Він бере участь у процесі дихання. Крізь легені кисень потрапляє у кров, розноситься нею по всьому організму і в клітинах забезпечує перебіг реакцій окиснення. Вони відбуваються з вивільненням енергії, за рахунок якої підтримується стала температура тіла у теплокровних і виконується робота: пересування, робота м'язів та інші життєві процеси. Реакції окиснення відбуваються і в рослинах, які також поглинають кисень під час дихання.
Добування кисню в промисловості. У промисловості кисень добувають перегонкою зрідженого повітря. Оскільки повітря — це суміш газів, переважно азоту й кисню, то спочатку випаровується азот, бо температура кипіння рідкого азоту (-196 °С) нижча від температури кипіння рідкого кисню (-183 °С), а рідкий кисень залишається. Його зберігають у стальних балонах та у спеціальних посудинах із подвійними стінками, між якими немає повітря, — у посудинах Дьюара (мал. 65). Через такі стінки теплота дуже повільно передається в середину посудини, і зріджений кисень випаровується повільно. Такі посудини використовують у звичайних термосах. Подібну будову мають великі металеві посудини — кисневі танки, в яких зберігають і перевозять кисень.
Мал. 65. Посудини Дьюара.
Короткі висновки
Оксиген — найпоширеніший елемент на Землі. Він міститься в атмосфері, літосфері, гідросфері та живих організмах. Оксиген утворює двохатомні молекули кисню О2 — простої речовини.
Кисень — життєво важлива речовина. За стандартних умок він являє собою газ без кольору, без запаху і смаку, малорозчинний у воді, трохи важчий за повітря.
У лабораторних умовах кисень добувають з оксигеновміснич речовин (наприклад, КМnО4, Н2О2) за допомогою реакції розкладу.
Завдання для самоконтролю
1. Схарактеризуй Оксиген як хімічний елемент. До складу яких природних речовин він входить?
2. Схарактеризуй кисень як просту речовину. Де він трапляється в природі?
3. Розглянь мал. 62 і 63 та назви два способи збирання кисню. Порівняй їх і вкажи, на яких фізичних властивостях кисню вони ґрунтуються?
4. Як можна добути кисень у лабораторії?
5. Що таке каталізатори і яке їх значення в хімічних процесах?
6. В одній колбі міститься кисень, у другій — повітря. Як розпізнати, в якій колбі кисень?
7. Яку масову частку становить Оксиген у складі калій перманганату?
8. Як ти думаєш, фізичні чи хімічні процеси використовують для добування кисню: а) у промисловості; б) в лабораторії.
Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
Планування уроків з хімії , відповіді на тести, завдання та відповіді по класам , домашнє завадання та робота з хімії 7 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













