|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
ВОДА ЯК РОЗЧИННИК. БУДОВА МОЛЕКУЛИ ВОДИ, ПОНЯТТЯ ПРО ВОДНЕВИЙ ЗВ'ЯЗОК
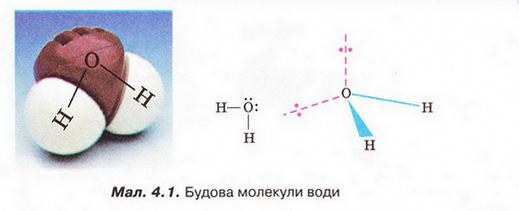
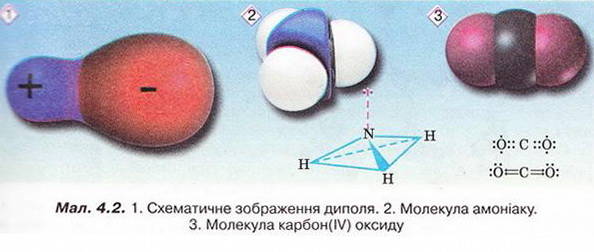
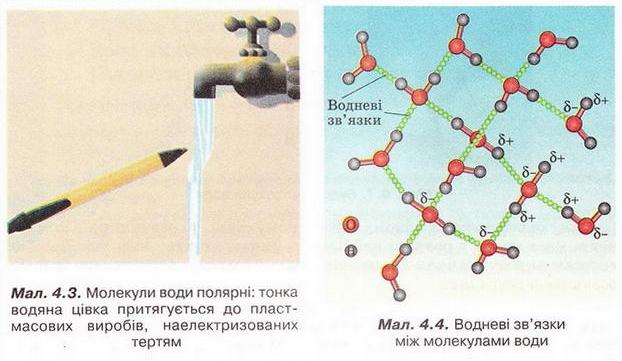
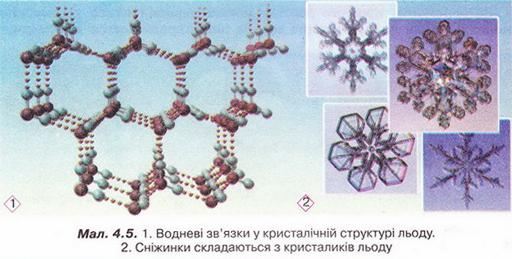
Розчин і його компоненти. Вода як розчинник, будова молекули води. Поняття про водневий зв'язок • Розчин і його компоненти деякою мірою знайомі вам з курсу природознавства. З попереднього параграфа ви дізналися, що розчин – однофазна гомогенна система, яка складається з двох або більше компонентів. Характерна ознака істинних розчинів – гомогенність. У істинних розчинах навіть за допомогою ультрамікроскопа не можна побачити окремих частинок їхніх складових. Завдання Поясніть, чому частинки дисперсної фази колоїдних розчинів можна досліджувати методом ультрамікроскопії, а частинки компонентів істинних розчинів – ні (за потреби зверніться до малюнка 3.2). Схарактеризуймо докладніше компоненти розчинів. Вам уже відомо, що розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники – рідини. Наприклад, дуже розповсюджені у природі водні розчини речовин. Завдання Наведіть кілька прикладів рідких розчинів, які трапляються у природі. Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті. Тож з’ясуймо ознаки класифікації розчинів, навчімось розрізняти їхні компоненти. Розчин утворений не менш ніж двома компонентами, один з яких – розчинник, а інші розчинені в ньому. Наприклад, у столовому оцті вода – розчинник, а оцтова кислота – розчинена речовина. Зазвичай розчинником уважають той компонент, який у чистому вигляді існує у тому самому агрегатному стані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Запам'ятайте, воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини. • Вода як розчинник має непересічне значення. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені насамперед хімічним складом і будовою молекули цієї сполуки. Тож розгляньмо особливості будови молекули води (мал. 4.1). Вам добре відомо, що до її складу входять два атоми Гідрогену й один атом Оксигену. З курсу хімії 8-го класу ви знаєте, що електронегативність Оксигену значно більша за електронегативність Гідрогену. Тому утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Що таке диполь і за яких умов молекула є диполем? Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною (мал. 4.2). Зверніть увагу: молекули, утворені атомами різних хімічних елементів, можуть, залежно від геометричної форми, бути полярними й неполярними. Якщо форма асиметрична (через наявність неподілених електронних гір або неспарених електронів), то молекула полярна (мал. 4.2,2). Якщо ж зміщення електронної густини симетричне, то молекула неполярна жал. 4.2,3). За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасового корпусу ручки чи ебонітової палички, наелектризованих тертям (мал. 4.3). Під впливом диполів води на поверхні речовин, занурених у неї, міжатомні й міжмолекулярні сили слабшають у 80 разів. Така висока діелектрична проникність з усіх відомих речовин властива тільки воді. Цим пояснюють її здатність бути універсальним розчинником. Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними так званих водневих зв'язків (мал. 4.4). З наявністю цих зв'язків пов'язані аномально високі (порівняно з леткими сполуками інших елементів VIA групи періодичної системи) температури кипіння і плавлення води. Завдяки водневим зв'язкам між молекулами вода виявляє унікальні властивості. Ці міжмолекулярні зв'язки стабілізують нещільну кристалічну структуру льоду (мал. 4.5). Завдання Роздивіться фрагменти (1) і (2) малюнка 4.5 і висловіть припущення щодо причин наявності у будь-якої сніжинки саме шести променів. Через особливості будови кристалів льоду його густина менша за густину води у рідкому агрегатному стані. Ця властивість запобігає глюмерзанню водойм. Під час подальшого вивчення хімії та біології ви дізнаєтеся, що утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Вони можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків. Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин. Докладніше про це ви дізнаєтеся з наступного параграфа. Цікаво? Більшість обрядових дій українців відбувалися біля води, бо ототожнювалися з водною стихією: купальські обряди, русалії й Водохреще, обливання та зорожіння на мосту, біля криниці чи ополонки. Водна магія та культ води лежали в основі багатьох вірувань та повір'їв, утілюючись у колоритних демонологічних обрядах, що стали етнічними символами духовної культури українців, - у образах русалки, нявки, водяника тощо. Стисло про головне Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники - рідини. Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті. Розчин утворений не менш ніж двома компонентами, один з яких - розчинник, а інші розчинені в ньому. Зазвичай розчинником вважають той компонент, який у чистому вигляді існує у тому самому агрегатному сгані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені хімічним складом і будовою молекули цієі сполуки. Утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною На поверхні речовин, занурених у воду, міжатомні й міжмолекулярні сили під впливом диполів води слабшають у 80 разів. Цим пояснюють здатність води бути універсальним розчинником. Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними водневих зв'язків. З наявністю цих зв'язків пов'язані аномально високі температури кипіння і плавлення води. Окрім води, утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Водневі зв'язки можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків. Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин. Застосуйте свої знання і уміння 1. Наведіть визначення розчину. 2. Назвіть характерну ознаку істинних розчинів. 3. Наведіть кілька прикладів твердих розчинів, які використовують у побуті. 4. Схарактеризуйте будову молекули води. 5. Доповніть речення. Істинний розчин є системою: 6. Виберіть розчини: 7. Виберіть усі правильні твердження:
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: