|
Гіпермаркет Знань>>Хімія>>Хімія 7 клас. Повні уроки>>Хімія: Атомна одиниця маси. Відносна атомна маса хімічних елементів. Повні уроки
Мета уроку1. Вивчити поняття атомна одиниця маси. Хід урокуАтомна одиниця масиАтомна одиниця маси (а. о м.), одиниця маси для вираження мас мікрочасток. За 1 а.е.м. прийнята 1 / 12 частина маси найбільш поширеного і легкого ізотопу вуглецю 12С з масовим числом 12 (т. зв. вуглецева шкала). 1 а.е.м. = 1,6605655 (86) • 10-27 кг. Для перекладу значень мас m частинок, виражених в а.е.м., в одиницю маси СІ (кг) користуються формулою:
Оскільки 1 а.е.м. є величиною, обернено пропорційній числу Авогадро, тобто 1/NA г, то молярна маса певного елементу, виражена в грамах на моль, цілком співпадає з масою атома цього елемента, вираженої в а. е. м.
Маса і кількість речовини - поняття різні. Маса виражається в кілограмах (грамах), а кількість речовини - в молях. Між масою речовини (т, м), кількістю речовини (п, моль) і молярною масою (М, г / моль) існують прості співвідношення: m = nM, n = m / MM = m / n За цим формулам легко обчислити масу визначеної кількості речовини, або визначити кількість речовини у відомій Ассе його, або знайти молярну масу речовини.
Поняття "Атомна маса" ввів Дж. Дальтон (1803). Він же вперше визначив Атомну масу. Великі роботи по встановленню Атомної маси були виконані в 1-ій половині 19 століття Я. Берцелиусом, пізніше Ж. С. Стасом і Т. У. Річардсом. У 1869 році Д. І. Менделєєв відкрив закон періодичної залежності властивостей елементів від Атомної маси і на його основі виправив Атомні маси багатьох відомих у той час елементів (Be, U, La і інших) і, крім того, передбачив Атомні маси ще не відкритих тоді Ga, Ge, Sc. Після відкриття Ф. Содді (1914) явища ізотопії поняття "Атомна маса" стали відносити і до елементів, що складається з суміші ізотопів, і до окремих ізотопів.
Контролюючий блок №11. Розкрийте поняття - атомна одиниця маси. Відносна атомна маса хімічних елементівСимволи, назви, атомні ваги і природний ізотопний склад деяких хімічних елементів.
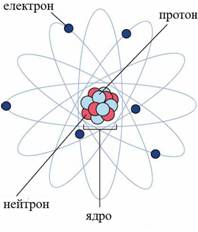
Атомна вага елемента дорівнює середньому значенню з атомних ваг всіх його природних ізотопів з урахуванням їх поширеності. Наприклад, елемент хлор в природі знаходиться у вигляді двох ізотопів: хлор-35 і хлор-37. Їх зміст становить 75,53% і 24,47% (див. табл. 1). Якщо загальний вміст двох ізотопів хлору в сумі прийняти за одиницю, то одного з них - приблизно 0,75 і іншого - приблизно 0,25 (в частках одиниці). Тоді атомна вага природного суміші двох ізотопів хлору закруглено дорівнює: Дефект маси - зменшення маси атома в порівнянні з сумарною масою всіх окремо взятих складових його елементарних частинок, обумовлене енергією їх зв'язку в атомі. Якщо "розібрати" ядро атома на окремі протони і нейтрони (наприклад, за допомогою ядерної реакції), то їх маса знову прийме саме ті значення, які нам вже відомі: 1,00728 а.о.м. для протона і 1,00867 а.е.м. для нейтрона. Дефект маси є наслідком універсального співвідношення E = Mc2, що випливає з теорії відносності А. Ейнштейна, де E - повна енергія системи, c = 3.1010 см / сек - швидкість світла у порожнечі, M - маса системи (у нашому випадку - атома). Тоді DM = DЕ/c2, де DM - дефект маси, а DE - енергія зв'язку нуклонів в ядрі, тобто енергія, яку необхідно затратити для поділу ядра атома на окремі протони і нейтрони. Таким чином, чим більше дефект маси, тим більше енергія зв'язування нуклонів в ядрі і тим стійкіше ядро атома елемента. Зі збільшенням числа протонів у ядрі (І масового числа) дефект маси спочатку зростає від нуля (для 1H) до максимуму (у 64Ni), а потім поступово зменшується для більш важких елементів.
Контролюючий блок №11. Від чого залежить середня виміряна атомна вага елемента? Список джерел1. Шиманович І.Є., Павлович М.Л., Тікавий В.Ф., Малашков П.М. "Загальна хімія в формулах, визначеннях, схемах"
Відредаговано та надіслано Горбатко С. М.
Бірюкова Г. І. Горбатко С. М.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: