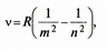|
Гіпермаркет Знань>>Фізика і астрономія>>Фізика 11 клас>> Фізика: Досліди Резерфорда. Ядерна модель атома. Квантові постулати Бора. Поглинання та випромінювання світла атомом
Для атомної фізики характерні відстані, сумірні з розміром атома (~10-10 м), та енергія порядку 10-19(Г19 Дж (кілька еВ) Модель атома Томсона називавють «пудинговою» — за аналогією з традиційним британський пирогом з родзинками Проте така модель атома мала свої обмеження і не відповідала дослідним фактам, отриманим на той час фізиками. Запропонувати більш реальну модель атома вдалося лише після дослідів Е. Резерфорда і формулювання квантових постулатів Н. Бором. Альфа-частинки — це позитивно заряджені частинки, заряд яких дорівнює двом зарядам електрона, а маса приблизно в чотири рази більша за масу атома Гідрогену, тобто це ядра атома Гелію У 1911 р. англійський фізик Е. Резерфорд, досліджуючи разом зі своїми співробітниками бомбардування альфа-частинками тонких металевих пластинок, встановив, що вони певним чином розсіюються в речовині (мал. 7.1). Вузький пучок швидких альфа-частинок 1 спрямовувався на тонку золоту чи платинову пластинку 2, за якою розміщувався екран 3, здатний фіксувати їх попадання на екран спалахами. За допомогою спеціального оптичного пристрою 4 можна була спостерігати і вимірювати кут відхилення ф альфачастинок. Дослід Е. Резерфорда започаткував основи сучасних уявлень про будову атома Більшість із них рухалася майже прямолінійно (кут відхилення ф становив 1—2°). Проте незначна їх частка відхилялася на більші кути; були зафіксовані навіть такі альфачастинки, які після розсіювання змінювали свій напрямок руху на протилежний (ф > 90°). Щоб пояснити одержані результати, Е. Резерфорд припустив, що атом має складну будову, схожу на Сонячну систему: всередині його міститься позитивно заряджене ядро, навколо якого обертаються електрони (мал. 7.2). Його розрахунки довели, що в ядрі зосереджена практично вся маса атома, але його розміри набагато менші за сам атом. Вимірювання показали, що лінійні розміри атома становлять приблизно 10-10 м, а радіус його ядра дорівнює близько 10-15 м. Зрозуміло, що схематичні зображення атомів тут і в інших книгах подаються без дотримання масштабів. Отже, на підставі одержаних експериментальних даних Е. Резерфорд запропонував ядерну модель атома, яка узгоджувалася з результатами дослідів і пояснювала багато інших явищ, пов'язаних з будовою атома. Справді, швидкі альфа-частинки легко долають простір електронних оболонок атомів, не зазнаючи з їхнього боку значного впливу, і тому майже не відхиляються від прямолінійної траєкторії руху. Проте коли вони пролітають досить близько від позитивно зарядженого ядра атома, кулонівська взаємодія між ядром і частинками змушує їх викривляти траєкторію і відхилятися на певний кут (мал. 7.3). Е. Резерфорд на основі законів електромагнітної взаємодії вивів формулу, яка дає змогу обчислити кількість а-частинок, розсіяних на кут ф, залежно від їх енергії і хімічної природи досліджуваного матеріалу. Пізніше ця теоретично виведена формула була експериментально підтверджена й остаточно утвердила в фізиці ядерну модель атома.
КВАНТОВІ ПОСТУЛАТИ БОРА Як відомо, атом Гідрогену є стійким утворенням, яке складається з ядра-протона й одного електрона, що обертається навколо нього під дією кулонівської сили взаємодії (мал. 7.4). Якщо вважати орбіту електрона коловою, то: З електродинаміки відомо, що електрон, який рухається з прискоренням, має випромінювати електромагнітні хвилі і поступово втрачати енергію, тобто з часом він мав би впасти на ядро, а атом — припинити існування. Отже, за класичними міркуваннями, атоми мають бути нестійкими утвореннями, які весь час випромінюють суцільний спектр електромагнітних хвиль. Проте цей висновок суперечить практиці, адже насправді атоми «живуть» тривалий час і випромінюють енергію лише за певних умов. Поклавши, що розмір атома r » 10-10 м, швидкість електрона дорівнюватиме v » 106 мс —, а його прискорення а « 1022 мс Квантові постулати Н. Бора усувають протиріччя між твердженнями класичної теорії і наявним результатом тривалого існування атомів Це протиріччя між класичною теорією і практикою спробував пояснити у 1913 р. відомий датський учений Нільс Бор, який сформулював квантові постулати: 1) атоми перебувають у певних стаціонарних станах, в яких вони не випромінюють електромагнітні хвилі; 2) під час переходу атома з одного стаціонарного стану, що характеризується енергією Еn, в інший з енергією Еm, він випромінює або поглинає квант енергії, що дорівнює hv= En - Em. (7.2) Перший постулат Н. Бора, який спростовував фундаментальні положення класичної фізики, був експериментально підтверджений у 1913 р. дослідами Д. Франка і Г. Герца, які досліджували залежність сили струму від напруги у скляній колбі, заповненій парою ртуті (мал. 7.5). Досліди Д. Франка і Г. Герца підтверджують, що атоми перебувають у певних стаціонарних станах Джерело струму Е створює напругу, завдяки якій електрони прямують до анода з прискоренням Електрони з катода К під дією електричного поля, створеного між електродами джерелом струму Е, прямують до сітки С й анода А. Між сіткою С й анодом А існує незначна напруга (0,5 В), яка гальмує повільні електрони, перешкоджаючи їх руху до анода. У дослідах Д. Франка і Г. Герца залежність сили струму від напруги не лінійна: за певної напруги існують максимальні значення струму Електрон-вольт (еВ) — це енергія, якої набуває електрон під дією прискорювальної напруги 1 В: 1 еВ = 1,6 · 10-19Дж У збудженому стані атоми можуть перебувати дуже короткий час (~10-8 с), після чого самочинно повертаються в основний незбуджений стан, випромінюючи світловий квант частотою Лінії атомних спектрів утворюють серії, які підлягають певним закономірностям. Так, для видимої частини спектру Гідрогену спектральні лінії утворюють серію Бальмера В інфрачервоній частині спектру для значень m = 3 і n = 4, 5, 6, ... виявлено лінії так званої серії Пашена Другий постулат Бора пояснював закономірності лінійчастих спектрів, природу яких класична фізика не змогла розкрити. У 1885 р. швейцарський учений Й. Бальмер встановив, що довжини хвиль спектральних ліній Гідрогену співвідносяться між собою з певною закономірністю: Згодом, у 1890 p., шведський фізик Й. Рідберг одержав більш загальну формулу для частот спектральних ліній атома Гідрогену: За цією формулою для ліній серії Бальмера m = 2, n = 3, 4, 5, 6; для ліній серії Пашена m = 3, n = 4, 5, 6, ... . Отже, квантові постулати Бора остаточно розв'язали труднощі класичної фізики щодо будови речовини. Вони пов'язали між собою ядерну модель атома Резерфорда, побудовану на основі класичної теорії, і квантовий характер змін внутрішнього стану атома, що було підтверджено експериментально, їхнє значення для розвитку сучасної фізики з'ясувалося згодом, під час становлення квантової механіки, в основу якої покладено ідею квантування значень фізичних величин.
1. Які відкриття стали поштовхом до розвитку сучасної фізики? 1. Чому виникли труднощі у класичному поясненні ядерної моделі атома? У чому вони виявилися? Є.В. Коршак, О.І. Ляшенко, В.Ф. Савченко, Фізика, 11 клас
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: