|
|
|
| Строка 5: |
Строка 5: |
| | <metakeywords>Физика, 9 класс, Строение атома</metakeywords> | | <metakeywords>Физика, 9 класс, Строение атома</metakeywords> |
| | | | |
| - | В 1897 г. было сделано открытие, позволившее объяснить большинство электрических явлений: английский ученый Дж. Дж. Томсон открыл частицу, являющуюся носителем элементарного заряда. Эту частицу назвали '''электроном'''.<br> Масса электрона оказалась почти в 2000 раз меньше массы самого легкого атома в природе - атома водорода. Заряд электрона отрицательный:<br>[[Image:tema3-1.jpg|center]]<br>Этот заряд является неотъемлемой характеристикой электрона. В отличие от обычных тел, которые можно зарядить или, наоборот, разрядить, «избавить» электрон от его заряда невозможно. Более того, заряд электрона нельзя ни увеличить, ни уменьшить. Он всегда имеет одно и то же значение.<br> Из курса химии вы знаете, что электроны входят в состав атомов. ''Электроны внутри атома обращаются вокруг положительно заряженного '''атомного ядра'''''.<br> Строение атома было открыто в 1911 г. в результате экспериментов, которыми руководил английский ученый Э. Резерфорд. Идея опытов состояла в том, чтобы выяснить, что происходит с быстро-летящими частицами, когда на их пути оказываются атомы вещества.<br> Нужно сказать, что за несколько лет до этого было открыто явление '''радиоактивности''': были обнаружены невидимые лучи, которые испускались некоторыми (теперь их называют ''радиоактивными'') веществами (ураном, радием и др.). Изучение этих лучей показало, что в общем случае они состоят из трех компонентов, отличающихся друг от друга электрическим зарядом. Для обозначения отдельных видов радиоактивных излучений было предложено использовать первые три буквы греческого алфавита: '''α''' (альфа), '''β''' (бета) и '''γ''' (гамма).<br> ''Альфа-лучи'' состоят из положительно заряженных частиц (альфа-частиц), ''бета-лучи'' - из отрицательно заряженных частиц (электронов), ''гамма-лучи'' - никаким зарядом не обладают. Эти лучи опасны для человека. Поэтому, работая с радиоактивными препаратами, следует соблюдать особые меры предосторожности: использовать специальные защитные экраны и, конечно, никогда не брать эти препараты руками.<br> Резерфорд предложил использовать альфа-частицы в качестве тех «снарядов», которыми можно было бы «бомбардировать» атомы вещества. Направив узкий пучок этих частиц на тонкую пластинку (фольгу) исследуемого вещества, он обнаружил, что большинство альфа-частиц пролетало через фольгу почти беспрепятственно и лишь очень небольшая их часть, столкнувшись с чем-то внутри атома, отскакивала от фольги назад. Более подробно об опытах Резерфорда будет рассказано в старших классах. Здесь же мы ограничимся тем выводом, к которому он пришел на основе анализа полученных данных. <br> Согласно Резерфорду, атом по своему строению напоминает Солнечную систему. Подобно тому как планеты, притягиваясь к Солнцу, движутся вокруг него, так и электроны в атоме движутся вокруг ядра, удерживаемые силами притяжения к нему. Из-за этого сходства модель строения атома (рис.11), предложенную Резерфордом, назвали ''планетарной моделью''. | + | В 1897 г. было сделано открытие, позволившее объяснить большинство электрических явлений: английский ученый Дж. Дж. Томсон открыл частицу, являющуюся носителем элементарного заряда. Эту частицу назвали '''электроном'''.<br> Масса электрона оказалась почти в 2000 раз меньше массы самого легкого атома в природе - атома водорода. Заряд электрона отрицательный:<br>[[Image:Tema3-1.jpg|center|198x27px]]Этот заряд является неотъемлемой характеристикой электрона. В отличие от обычных тел, которые можно зарядить или, наоборот, разрядить, «избавить» электрон от его заряда невозможно. Более того, заряд электрона нельзя ни увеличить, ни уменьшить. Он всегда имеет одно и то же значение.<br> Из курса химии вы знаете, что электроны входят в состав атомов. ''Электроны внутри атома обращаются вокруг положительно заряженного '''атомного ядра'''''.<br> Строение атома было открыто в 1911 г. в результате экспериментов, которыми руководил английский ученый Э. Резерфорд. Идея опытов состояла в том, чтобы выяснить, что происходит с быстро-летящими частицами, когда на их пути оказываются атомы вещества.<br> Нужно сказать, что за несколько лет до этого было открыто явление '''радиоактивности''': были обнаружены невидимые лучи, которые испускались некоторыми (теперь их называют ''радиоактивными'') веществами (ураном, радием и др.). Изучение этих лучей показало, что в общем случае они состоят из трех компонентов, отличающихся друг от друга электрическим зарядом. Для обозначения отдельных видов радиоактивных излучений было предложено использовать первые три буквы греческого алфавита: '''α''' (альфа), '''β''' (бета) и '''γ''' (гамма).<br> ''Альфа-лучи'' состоят из положительно заряженных частиц (альфа-частиц), ''бета-лучи'' - из отрицательно заряженных частиц (электронов), ''гамма-лучи'' - никаким зарядом не обладают. Эти лучи опасны для человека. Поэтому, работая с радиоактивными препаратами, следует соблюдать особые меры предосторожности: использовать специальные защитные экраны и, конечно, никогда не брать эти препараты руками.<br> Резерфорд предложил использовать альфа-частицы в качестве тех «снарядов», которыми можно было бы «бомбардировать» атомы вещества. Направив узкий пучок этих частиц на тонкую пластинку (фольгу) исследуемого вещества, он обнаружил, что большинство альфа-частиц пролетало через фольгу почти беспрепятственно и лишь очень небольшая их часть, столкнувшись с чем-то внутри атома, отскакивала от фольги назад. Более подробно об опытах Резерфорда будет рассказано в старших классах. Здесь же мы ограничимся тем выводом, к которому он пришел на основе анализа полученных данных. <br> Согласно Резерфорду, атом по своему строению напоминает Солнечную систему. Подобно тому как планеты, притягиваясь к Солнцу, движутся вокруг него, так и электроны в атоме движутся вокруг ядра, удерживаемые силами притяжения к нему. Из-за этого сходства модель строения атома (рис.11), предложенную Резерфордом, назвали ''планетарной моделью''. |
| | | | |
| - | [[Image:f11.jpg|center]] Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!<br> Подсчитано, что если бы все электроны примкнули вплотную к атомным ядрам, то объем тела взрослого человека стал бы равным одной миллионной доле кубического миллиметра! Это означает, что более 99% внутри тела человека (как и любого другого тела) занимает пустота! Именно через пустоту внутри атомов и пролетали те альфа-частицы в опыте Резерфорда, которые не отклонялись фольгой назад.<br> Совокупность атомов одного вида называют '''химическим элементом'''. Атомы разных химических элементов отличаются друг от друга зарядом своих ядер и числом электронов, обращающихся вокруг них. Так, например, в атоме водорода движется всего лишь один электрон, в атоме кислорода - восемь электронов, в атоме урана - девяносто два.<br> ''Число электронов в атоме совпадает с порядковым номером элемента в таблице Д. И. Менделеева''. Через этот же номер выражается и заряд атомного ядра. Введем обозначение:<br> Z - порядковый номер элемента = число электронов в атоме.<br> Тогда для заряда атомного ядра и общего заряда всех электронов в атоме можно записать:<br>[[Image:tema3-2.jpg|center]]Сложив общий заряд электронов в атоме с зарядом атомного ядра, мы получим нуль. Это означает, что ''в целом атом нейтрален''. Нейтральными являются и молекулы вещества, так как они состоят из нейтральных атомов.<br> В некоторых случаях (например, при столкновениях) атомы могут потерять один или несколько своих электронов. Вместе с электронами атомы теряют часть своего отрицательного заряда и перестают быть нейтральными. Образующийся в результате этого положительно заряженный атом называют '''положительным ионом'''.<br> Бывают и обратные случаи: нейтральный атом присоединяет к себе лишний электрон и становится отрицательно заряженным. Такой атом называют '''отрицательным ионом'''.<br> | + | [[Image:F11.jpg|center|141x177px]] Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!<br> Подсчитано, что если бы все электроны примкнули вплотную к атомным ядрам, то объем тела взрослого человека стал бы равным одной миллионной доле кубического миллиметра! Это означает, что более 99% внутри тела человека (как и любого другого тела) занимает пустота! Именно через пустоту внутри атомов и пролетали те альфа-частицы в опыте Резерфорда, которые не отклонялись фольгой назад.<br> Совокупность атомов одного вида называют '''химическим элементом'''. Атомы разных химических элементов отличаются друг от друга зарядом своих ядер и числом электронов, обращающихся вокруг них. Так, например, в атоме водорода движется всего лишь один электрон, в атоме кислорода - восемь электронов, в атоме урана - девяносто два.<br> ''Число электронов в атоме совпадает с порядковым номером элемента в таблице Д. И. Менделеева''. Через этот же номер выражается и заряд атомного ядра. Введем обозначение:<br> Z - порядковый номер элемента = число электронов в атоме.<br> Тогда для заряда атомного ядра и общего заряда всех электронов в атоме можно записать:<br>[[Image:Tema3-2.jpg|center|108x44px]]Сложив общий заряд электронов в атоме с зарядом атомного ядра, мы получим нуль. Это означает, что ''в целом атом нейтрален''. Нейтральными являются и молекулы вещества, так как они состоят из нейтральных атомов.<br> В некоторых случаях (например, при столкновениях) атомы могут потерять один или несколько своих электронов. Вместе с электронами атомы теряют часть своего отрицательного заряда и перестают быть нейтральными. Образующийся в результате этого положительно заряженный атом называют '''положительным ионом'''.<br> Бывают и обратные случаи: нейтральный атом присоединяет к себе лишний электрон и становится отрицательно заряженным. Такой атом называют '''отрицательным ионом'''.<br> |
| | | | |
| | + | <br> |
| | | | |
| | + | ??? <br> 1. Кто и когда открыл электрон? <br> 2. Как заряжен электрон? <br> 3. Вокруг чего обращаются электроны внутри атома? <br> 4. Как заряжено атомное ядро? <br> 5. Докажите, что атом в целом нейтрален. <br> 6. Кто и когда открыл строение атома? <br> 7. Чем отличаются альфа-, бета- и гамма-лучи друг от друга? <br> 8. Приведите примеры радиоактивных веществ. <br> 9. Почему большинство альфа-частиц в опыте Резерфорда практически беспрепятственно пролетало сквозь фольгу? <br> 10. На что наталкивались внутри атома альфа-частицы, которые в опыте Резерфорда отскакивали от фольги назад? <br> 11. Чем отличаются друг от друга атомы разных химических элементов? <br> 12. Что представляют собой положительные и отрицательные ионы? Как они образуются?<br> |
| | | | |
| - | ??? <br> 1. Кто и когда открыл электрон? <br> 2. Как заряжен электрон? <br> 3. Вокруг чего обращаются электроны внутри атома? <br> 4. Как заряжено атомное ядро? <br> 5. Докажите, что атом в целом нейтрален. <br> 6. Кто и когда открыл строение атома? <br> 7. Чем отличаются альфа-, бета- и гамма-лучи друг от друга? <br> 8. Приведите примеры радиоактивных веществ. <br> 9. Почему большинство альфа-частиц в опыте Резерфорда практически беспрепятственно пролетало сквозь фольгу? <br> 10. На что наталкивались внутри атома альфа-частицы, которые в опыте Резерфорда отскакивали от фольги назад? <br> 11. Чем отличаются друг от друга атомы разных химических элементов? <br> 12. Что представляют собой положительные и отрицательные ионы? Как они образуются?<br>
| + | <br> ''С.В. Громов, И.А. Родина, Физика 9 класс'' |
| - | | + | |
| - | | + | |
| - | ''С.В. Громов, И.А. Родина, Физика 9 класс'' | + | |
| | | | |
| | <br> <sub>Планирование уроков [[Физика и астрономия|по физике]], ответы на тесты, задания и ответы по классам, домашнее задание и работа [[Физика 9 класс|по физике для 9 класса]]</sub> | | <br> <sub>Планирование уроков [[Физика и астрономия|по физике]], ответы на тесты, задания и ответы по классам, домашнее задание и работа [[Физика 9 класс|по физике для 9 класса]]</sub> |
Версия 11:07, 27 июня 2010
Гипермаркет знаний>>Физика и астрономия>>Физика 9 класс>>Физика: Строение атома
В 1897 г. было сделано открытие, позволившее объяснить большинство электрических явлений: английский ученый Дж. Дж. Томсон открыл частицу, являющуюся носителем элементарного заряда. Эту частицу назвали электроном.
Масса электрона оказалась почти в 2000 раз меньше массы самого легкого атома в природе - атома водорода. Заряд электрона отрицательный:
Этот заряд является неотъемлемой характеристикой электрона. В отличие от обычных тел, которые можно зарядить или, наоборот, разрядить, «избавить» электрон от его заряда невозможно. Более того, заряд электрона нельзя ни увеличить, ни уменьшить. Он всегда имеет одно и то же значение.
Из курса химии вы знаете, что электроны входят в состав атомов. Электроны внутри атома обращаются вокруг положительно заряженного атомного ядра.
Строение атома было открыто в 1911 г. в результате экспериментов, которыми руководил английский ученый Э. Резерфорд. Идея опытов состояла в том, чтобы выяснить, что происходит с быстро-летящими частицами, когда на их пути оказываются атомы вещества.
Нужно сказать, что за несколько лет до этого было открыто явление радиоактивности: были обнаружены невидимые лучи, которые испускались некоторыми (теперь их называют радиоактивными) веществами (ураном, радием и др.). Изучение этих лучей показало, что в общем случае они состоят из трех компонентов, отличающихся друг от друга электрическим зарядом. Для обозначения отдельных видов радиоактивных излучений было предложено использовать первые три буквы греческого алфавита: α (альфа), β (бета) и γ (гамма).
Альфа-лучи состоят из положительно заряженных частиц (альфа-частиц), бета-лучи - из отрицательно заряженных частиц (электронов), гамма-лучи - никаким зарядом не обладают. Эти лучи опасны для человека. Поэтому, работая с радиоактивными препаратами, следует соблюдать особые меры предосторожности: использовать специальные защитные экраны и, конечно, никогда не брать эти препараты руками.
Резерфорд предложил использовать альфа-частицы в качестве тех «снарядов», которыми можно было бы «бомбардировать» атомы вещества. Направив узкий пучок этих частиц на тонкую пластинку (фольгу) исследуемого вещества, он обнаружил, что большинство альфа-частиц пролетало через фольгу почти беспрепятственно и лишь очень небольшая их часть, столкнувшись с чем-то внутри атома, отскакивала от фольги назад. Более подробно об опытах Резерфорда будет рассказано в старших классах. Здесь же мы ограничимся тем выводом, к которому он пришел на основе анализа полученных данных.
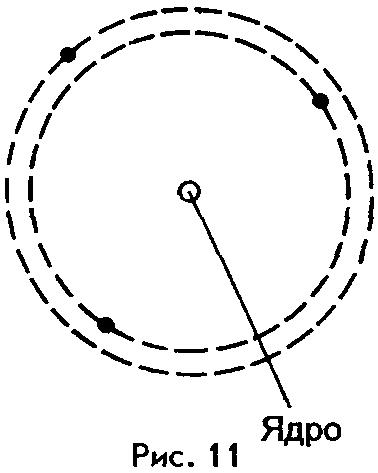
Согласно Резерфорду, атом по своему строению напоминает Солнечную систему. Подобно тому как планеты, притягиваясь к Солнцу, движутся вокруг него, так и электроны в атоме движутся вокруг ядра, удерживаемые силами притяжения к нему. Из-за этого сходства модель строения атома (рис.11), предложенную Резерфордом, назвали планетарной моделью.
Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!
Подсчитано, что если бы все электроны примкнули вплотную к атомным ядрам, то объем тела взрослого человека стал бы равным одной миллионной доле кубического миллиметра! Это означает, что более 99% внутри тела человека (как и любого другого тела) занимает пустота! Именно через пустоту внутри атомов и пролетали те альфа-частицы в опыте Резерфорда, которые не отклонялись фольгой назад.
Совокупность атомов одного вида называют химическим элементом. Атомы разных химических элементов отличаются друг от друга зарядом своих ядер и числом электронов, обращающихся вокруг них. Так, например, в атоме водорода движется всего лишь один электрон, в атоме кислорода - восемь электронов, в атоме урана - девяносто два.
Число электронов в атоме совпадает с порядковым номером элемента в таблице Д. И. Менделеева. Через этот же номер выражается и заряд атомного ядра. Введем обозначение:
Z - порядковый номер элемента = число электронов в атоме.
Тогда для заряда атомного ядра и общего заряда всех электронов в атоме можно записать:
Сложив общий заряд электронов в атоме с зарядом атомного ядра, мы получим нуль. Это означает, что в целом атом нейтрален. Нейтральными являются и молекулы вещества, так как они состоят из нейтральных атомов.
В некоторых случаях (например, при столкновениях) атомы могут потерять один или несколько своих электронов. Вместе с электронами атомы теряют часть своего отрицательного заряда и перестают быть нейтральными. Образующийся в результате этого положительно заряженный атом называют положительным ионом.
Бывают и обратные случаи: нейтральный атом присоединяет к себе лишний электрон и становится отрицательно заряженным. Такой атом называют отрицательным ионом.
???
1. Кто и когда открыл электрон?
2. Как заряжен электрон?
3. Вокруг чего обращаются электроны внутри атома?
4. Как заряжено атомное ядро?
5. Докажите, что атом в целом нейтрален.
6. Кто и когда открыл строение атома?
7. Чем отличаются альфа-, бета- и гамма-лучи друг от друга?
8. Приведите примеры радиоактивных веществ.
9. Почему большинство альфа-частиц в опыте Резерфорда практически беспрепятственно пролетало сквозь фольгу?
10. На что наталкивались внутри атома альфа-частицы, которые в опыте Резерфорда отскакивали от фольги назад?
11. Чем отличаются друг от друга атомы разных химических элементов?
12. Что представляют собой положительные и отрицательные ионы? Как они образуются?
С.В. Громов, И.А. Родина, Физика 9 класс
Планирование уроков по физике, ответы на тесты, задания и ответы по классам, домашнее задание и работа по физике для 9 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|