|
|
|
| Строка 3: |
Строка 3: |
| | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Метанол, етанол, їхні молекулярні, електронні та структурні формули, фізичні властивості, Хімічні властивості.</metakeywords>МЕТАНОЛ, ЕТАНОЛ, ЇХНІ МОЛЕКУЛЯРНІ, ЕЛЕКТРОННІ ТА СТРУКТУРНІ ФОРМУЛИ, ФІЗИЧНІ ВЛАСТИВОСТІ. ФУНКЦІОНАЛЬНА ГІДРОКСИЛЬНА ГРУПА. ХІМІЧНІ ВЛАСТИВОСТІ: ПОВНЕ ОКИСНЕННЯ, ВЗАЄМОДІЯ З НАТРІЄМ. ЗАСТОСУВАННЯ МЕТАНОЛУ ТА ЕТАНОЛУ. ОТРУЙНІСТЬ СПИРТІВ, ЇХ ЗГУБНА ДІЯ НА ОРГАНІЗМ ЛЮДИНИ | | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Метанол, етанол, їхні молекулярні, електронні та структурні формули, фізичні властивості, Хімічні властивості.</metakeywords>МЕТАНОЛ, ЕТАНОЛ, ЇХНІ МОЛЕКУЛЯРНІ, ЕЛЕКТРОННІ ТА СТРУКТУРНІ ФОРМУЛИ, ФІЗИЧНІ ВЛАСТИВОСТІ. ФУНКЦІОНАЛЬНА ГІДРОКСИЛЬНА ГРУПА. ХІМІЧНІ ВЛАСТИВОСТІ: ПОВНЕ ОКИСНЕННЯ, ВЗАЄМОДІЯ З НАТРІЄМ. ЗАСТОСУВАННЯ МЕТАНОЛУ ТА ЕТАНОЛУ. ОТРУЙНІСТЬ СПИРТІВ, ЇХ ЗГУБНА ДІЯ НА ОРГАНІЗМ ЛЮДИНИ |
| | | | |
| - | <br> | + | <br> |
| | | | |
| - | <u>Метанол, етанол, гліцерин</u><br> | + | <u>Метанол, етанол, гліцерин</u><br> |
| | | | |
| - | Після опрацювання § 27 ви зможете:<br> | + | Після опрацювання § 27 ви зможете:<br> |
| | | | |
| - | складати й пояснювати молекулярні, електронні та структурні формули метанолу, етанолу, гліцерину; збирати моделі їхніх молекул; характеризувати склад, структуру, фізичні та хімічні властивості цих сполук; ілюструвати властивості метанолу, етанолу, гліцерину рівняннями хімічних реакцій розрізняти спирти за функціональними ознаками.<br> | + | складати й пояснювати молекулярні, електронні та структурні формули метанолу, етанолу, гліцерину; збирати моделі їхніх молекул; характеризувати склад, структуру, фізичні та хімічні властивості цих сполук; ілюструвати властивості метанолу, етанолу, гліцерину рівняннями хімічних реакцій розрізняти спирти за функціональними ознаками.<br> |
| | | | |
| - | На шляху до успіху пригадаємо з вивчених курсів хімії, біології, основ здоров'я:<br> | + | На шляху до успіху пригадаємо з вивчених курсів хімії, біології, основ здоров'я:<br> |
| | | | |
| - | які хімічні елементи, окрім Карбону, є органогенами; яка валентність Карбону й Оксигену в органічних сполуках; який склад гідроксильної групи, у яких неорганічних сполуках вона трапляється; що таке електронегативність і як утворюється ковалентний полярний зв'язок; що таке водневий зв'язок і як він позначається на властивостях речовин; як і чому змінюється характер горіння вуглеводнів залежно від умісту Карбону; що таке гідрати; які продукту згоряння вуглеводнів і як їх виявляють; як вода реагує з активними металами.<br> | + | які хімічні елементи, окрім Карбону, є органогенами; яка валентність Карбону й Оксигену в органічних сполуках; який склад гідроксильної групи, у яких неорганічних сполуках вона трапляється; що таке електронегативність і як утворюється ковалентний полярний зв'язок; що таке водневий зв'язок і як він позначається на властивостях речовин; як і чому змінюється характер горіння вуглеводнів залежно від умісту Карбону; що таке гідрати; які продукту згоряння вуглеводнів і як їх виявляють; як вода реагує з активними металами.<br> |
| | | | |
| - | Ви, звичайно, пам'ятаєте (див. § 18), що до складу органічних сполук, окрім Карбону й Гідрогену, може входити також Оксиген. Зокрема, до оксигеновмісних органічних сполук належать спирти - метанол, етанол, гліцерин (у сучасній науковій хімічній літературі вам траплятиметься й інша назва гліцерину - гліцерол). Ви, напевно, звернули увагу на суфікс -ол у назвах цих речовин. Що він означає, на які особливості хімічного складу і будови молекул спиртів вказує? Аби з'ясувати це, розгляньмо моделі, за допомогою яких унаочнюють склад і будову молекул спиртів.<br> | + | Ви, звичайно, пам'ятаєте (див. § 18), що до складу органічних сполук, окрім Карбону й Гідрогену, може входити також Оксиген. Зокрема, до оксигеновмісних органічних сполук належать спирти - метанол, етанол, гліцерин (у сучасній науковій хімічній літературі вам траплятиметься й інша назва гліцерину - гліцерол). Ви, напевно, звернули увагу на суфікс -ол у назвах цих речовин. Що він означає, на які особливості хімічного складу і будови молекул спиртів вказує? Аби з'ясувати це, розгляньмо моделі, за допомогою яких унаочнюють склад і будову молекул спиртів.<br> |
| | | | |
| - | • ''Молекулярні, електронні та структурні формули метанолу, етанолу, й гліцерину'' наведені на малюнку 27.1.<br> | + | • ''Молекулярні, електронні та структурні формули метанолу, етанолу, й гліцерину'' наведені на малюнку 27.1.<br> |
| | | | |
| - | Наявність однієї (чи кількох) груп атомів -ОН є очевидною спільною рисою структур метанолу, етанолу й гліцеролу. Ці речовини можна розглядати як похідні алканів. Приміром, якщо у структурній формулі метану один з чотирьох атомів Гідрогену замінити на гідроксильну групу, дістанемо структурну формулу метанолу. Внаслідок аналогічної дії зі структурною формулою етану одержимо структурну формулу етанолу. Аби зобразити структурну формулу гліцерину, достатньо у структурній формулі пропану замінити на групу -ОН атом Гідрогену біля кожного з трьох атомів Карбону.<br>
| + | [[Image:Chemistry_183.jpg]] |
| | | | |
| - | Метанол і етанол - похідні насичених вуглеводнів, їхні молекули містять по одній гідроксильній групі. Тому ці спирти називають насиченими одноатомними спиртами. Гліцерол - насичений трьохатомний спирт (поясніть, чому).<br>
| + | Наявність однієї (чи кількох) груп атомів -ОН є очевидною спільною рисою структур метанолу, етанолу й гліцеролу. Ці речовини можна розглядати як похідні алканів. Приміром, якщо у структурній формулі метану один з чотирьох атомів Гідрогену замінити на гідроксильну групу, дістанемо структурну формулу метанолу. Внаслідок аналогічної дії зі структурною формулою етану одержимо структурну формулу етанолу. Аби зобразити структурну формулу гліцерину, достатньо у структурній формулі пропану замінити на групу -ОН атом Гідрогену біля кожного з трьох атомів Карбону.<br> |
| | | | |
| - | Групу - Н називають функціональною групою спиртів - адже вона зумовлює їхні хімічні властивості - здатність вступати в хімічні реакції.<br>
| + | Метанол і етанол - похідні насичених вуглеводнів, їхні молекули містять по одній гідроксильній групі. Тому ці спирти називають насиченими одноатомними спиртами. Гліцерол - насичений трьохатомний спирт (поясніть, чому).<br> |
| | | | |
| - | • ''Фізичні властивості метанолу, етанолу й гліцерину''<br>
| + | Групу - Н називають функціональною групою спиртів - адже вона зумовлює їхні хімічні властивості - здатність вступати в хімічні реакції.<br> |
| | | | |
| - | З огляду на це, не дивно, що метанол, етанол і гліцерин добре розчиняються в полярних розчинниках, передусім воді. З нею вони змішуються в будь-яких співвідношеннях (пригадайте, про це йшлося в § 4-6).<br>
| + | • ''Фізичні властивості метанолу, етанолу й гліцерину''<br> |
| | | | |
| - | Аби дослідити розчинення гліцерину у воді, виконаймо лабораторний дослід.<br>
| + | З огляду на це, не дивно, що метанол, етанол і гліцерин добре розчиняються в полярних розчинниках, передусім воді. З нею вони змішуються в будь-яких співвідношеннях (пригадайте, про це йшлося в § 4-6).<br> |
| | | | |
| - | ЛАБОРАТОРНИЙ ДОСЛІД<br>
| + | Аби дослідити розчинення гліцерину у воді, виконаймо лабораторний дослід.<br> |
| | | | |
| - | Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ<br>
| + | ЛАБОРАТОРНИЙ ДОСЛІД<br> |
| | | | |
| - | ''№ 8. Фізичні властивості гліцерину''<br>
| + | Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ<br> |
| | | | |
| - | Завдання<br>
| + | ''№ 8. Фізичні властивості гліцерину''<br> |
| | | | |
| - | Дослідіть фізичні властивості гліцерину.<br>
| + | Завдання<br> |
| | | | |
| - | Обладнання: градуйована пробірка або піпетка, пробірка, фільтрувальний папір. Реактиви: гліцерин; чорнило або харчовий водорозчинний барвник, дистильована вода.<br>
| + | Дослідіть фізичні властивості гліцерину.<br> |
| | | | |
| - | Інструкція. 1. Розгляньте гліцерин у склянці, трохи нахиліть її. Чи має гліцерин колір? Чи в'язка ця рідина? Пригадайте прийоми визначення запаху речовин. Відкрийте склянку з гліцерином, визначте, чи має він запах. На аркуш фільтрувального паперу нанесіть краплю гліцерину, на інший аркуш - краплю води. Наприкінці уроку переконайтеся, що папір з водою висох, а з гліцерином став ще вологішим (вбирає до 40 % вологи).<br>
| + | Обладнання: градуйована пробірка або піпетка, пробірка, фільтрувальний папір. Реактиви: гліцерин; чорнило або харчовий водорозчинний барвник, дистильована вода.<br> |
| | | | |
| - | 2. Налийте в пробірку воду об'ємом 0,5 мл і добавте краплю барвника. Суміш збовтайте. Добавте в пробірку 2 краплі гліцерину, збовтайте. Добавте ще краплю гліцерину і знову збовтайте. Чи розчиняється гліцерин у воді? Для чого воду попередньо підфарбували?<br>
| + | Інструкція. 1. Розгляньте гліцерин у склянці, трохи нахиліть її. Чи має гліцерин колір? Чи в'язка ця рідина? Пригадайте прийоми визначення запаху речовин. Відкрийте склянку з гліцерином, визначте, чи має він запах. На аркуш фільтрувального паперу нанесіть краплю гліцерину, на інший аркуш - краплю води. Наприкінці уроку переконайтеся, що папір з водою висох, а з гліцерином став ще вологішим (вбирає до 40 % вологи).<br> |
| | | | |
| - | Під час розчинення метанолу й етанолу між їхніми молекулами й мо¬лекулами води утворюються водневі зв'язки (мал. 27.2).<br>
| + | 2. Налийте в пробірку воду об'ємом 0,5 мл і добавте краплю барвника. Суміш збовтайте. Добавте в пробірку 2 краплі гліцерину, збовтайте. Добавте ще краплю гліцерину і знову збовтайте. Чи розчиняється гліцерин у воді? Для чого воду попередньо підфарбували?<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | Під час розчинення метанолу й етанолу між їхніми молекулами й мо¬лекулами води утворюються водневі зв'язки (мал. 27.2).<br> |
| | | | |
| - | За малюнком 27.2 опишіть утворення водневих зв'язків між молекулами етанолу й води. Між якими атомами вони виникають? На якому з них зосереджений частковий позитивний заряд, а на якому - частковий негативний?<br>
| + | [[Image:Chemistry_184.jpg]] |
| | | | |
| - | Водночас ці спирти, завдяки наявності в їхньому складі неполярних залишків насичених вуглеводнів, розчиняються в слабополярних органічних розчинниках і самі є розчинниками для багатьох неорганічних і органічних речовин.<br>
| + | <u>''Завдання''</u><br> |
| | | | |
| - | Температури кипіння (мал. 27.3) метанолу, етанолу й гліцерину значно вищі порівняно з алканами з такою самою кількістю атомів Карбону в ланцюзі. Також впадає в очі різке збільшення температури кипіння трьохатомного спирту гліцерину порівняно з одноатомними спиртами метанолом і етанолом.<br>
| + | За малюнком 27.2 опишіть утворення водневих зв'язків між молекулами етанолу й води. Між якими атомами вони виникають? На якому з них зосереджений частковий позитивний заряд, а на якому - частковий негативний?<br> |
| | | | |
| - | Описані явища пов'язані з утворенням між молекулами спиртів водневих зв'язків (мал. 27.4). На їхнє руйнування треба витратити значну кількість енергії, аби спирт перейшов з рідкого стану в газуватий. Зрозуміло, що між молекулами гліцерину утворюється значно більша кількість водневих зв'язків порівняно з метанолом і етанолом. Тож і температура кипіння гліцерину істотно вища.<br>
| + | Водночас ці спирти, завдяки наявності в їхньому складі неполярних залишків насичених вуглеводнів, розчиняються в слабополярних органічних розчинниках і самі є розчинниками для багатьох неорганічних і органічних речовин.<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | Температури кипіння (мал. 27.3) метанолу, етанолу й гліцерину значно вищі порівняно з алканами з такою самою кількістю атомів Карбону в ланцюзі. Також впадає в очі різке збільшення температури кипіння трьохатомного спирту гліцерину порівняно з одноатомними спиртами метанолом і етанолом.<br> |
| | | | |
| - | За малюнком 27.4 опишіть утворення водневих зв'язків між молекулами метанолу. Між якими атомами виникають водневі зв'язки? На якому з атомів зосереджений частковий позитивний заряд, а на якому - частковий негативний?<br>
| + | [[Image:Chemistry_185.jpg]] |
| | | | |
| - | В'язкість гліцерину, відсутність у нього запаху та солодкий смак (грецьке glicos означає солодкий) також пов'язані з наявністю в його молекулі трьох гідроксильних груп. Натомість метанол й етанол - леткі речовини з характерним «алкогольним» запахом і «пекучим» смаком. Усі ці рідини безбарвні й прозорі. (Про те, як було відкрито гліцерин ви дізнаєтеся з § 30, а про добування етанолу з природної сировини йтиметься в § 33.)<br>
| + | Описані явища пов'язані з утворенням між молекулами спиртів водневих зв'язків (мал. 27.4). На їхнє руйнування треба витратити значну кількість енергії, аби спирт перейшов з рідкого стану в газуватий. Зрозуміло, що між молекулами гліцерину утворюється значно більша кількість водневих зв'язків порівняно з метанолом і етанолом. Тож і температура кипіння гліцерину істотно вища.<br> |
| | | | |
| - | • ''Хімічні властивості метанолу, етанолу й гліцерину'' також зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти беруть участь у найрізноманітніших хімічних перетвореннях, з якими ви матимете нагоду ознайомитися під час вивчення хімії в старшій школі. Розгляньмо дві важливі реакції за участю спиртів і встановімо, чим зумовлений їхній перебіг.<br>
| + | [[Image:Chemistry_186.jpg]] |
| | | | |
| - | Приклад реакції повного окиснення спиртів ви неодноразово спостерігали під час горіння етанолу в спиртовому пальнику й, напевно, звернули увагу на характерний колір полум'я. Варто пам'ятати, що етанол - легкозаймиста речовина й потребує особливо обережного поводження - адже його пара спалахує за 13 °С. Полум'я метанолу, так саме як і етанолу, некіптяве.<br>
| + | <u>''Завдання''</u><br> |
| | | | |
| - | Який характер горіння гліцерину? Можна припустити, що світність його полум'я має бути більшою порівняно з метанолом й етанолом - адже в молекулі гліцерину міститься три атоми Карбону. Експериментальна перевірка спростовує наші припущення. Якщо в тигельку нагріти кипіння гліцерин об'ємом 1 мл й підпалити його пару, можна пересвідчитися, що вона горить майже безбарвним полум'ям. Це, на перший погляд, парадоксальне явище легко пояснити, обчисливши масові частки Карбону в метанолі, етанолі й гліцерині {викопайте ці обчислення).<br>
| + | За малюнком 27.4 опишіть утворення водневих зв'язків між молекулами метанолу. Між якими атомами виникають водневі зв'язки? На якому з атомів зосереджений частковий позитивний заряд, а на якому - частковий негативний?<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | В'язкість гліцерину, відсутність у нього запаху та солодкий смак (грецьке glicos означає солодкий) також пов'язані з наявністю в його молекулі трьох гідроксильних груп. Натомість метанол й етанол - леткі речовини з характерним «алкогольним» запахом і «пекучим» смаком. Усі ці рідини безбарвні й прозорі. (Про те, як було відкрито гліцерин ви дізнаєтеся з § 30, а про добування етанолу з природної сировини йтиметься в § 33.)<br> |
| | | | |
| - | Аби гліцерин зайнявся, його треба нагріти до значно вищої температури, ніж приміром, етанол. Поясніть, чому.<br> | + | • ''Хімічні властивості метанолу, етанолу й гліцерину'' також зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти беруть участь у найрізноманітніших хімічних перетвореннях, з якими ви матимете нагоду ознайомитися під час вивчення хімії в старшій школі. Розгляньмо дві важливі реакції за участю спиртів і встановімо, чим зумовлений їхній перебіг.<br> |
| | + | |
| | + | Приклад реакції повного окиснення спиртів ви неодноразово спостерігали під час горіння етанолу в спиртовому пальнику й, напевно, звернули увагу на характерний колір полум'я. Варто пам'ятати, що етанол - легкозаймиста речовина й потребує особливо обережного поводження - адже його пара спалахує за 13 °С. Полум'я метанолу, так саме як і етанолу, некіптяве.<br> |
| | + | |
| | + | Який характер горіння гліцерину? Можна припустити, що світність його полум'я має бути більшою порівняно з метанолом й етанолом - адже в молекулі гліцерину міститься три атоми Карбону. Експериментальна перевірка спростовує наші припущення. Якщо в тигельку нагріти кипіння гліцерин об'ємом 1 мл й підпалити його пару, можна пересвідчитися, що вона горить майже безбарвним полум'ям. Це, на перший погляд, парадоксальне явище легко пояснити, обчисливши масові частки Карбону в метанолі, етанолі й гліцерині {викопайте ці обчислення).<br> |
| | + | |
| | + | <u>''Завдання''</u><br> |
| | + | |
| | + | Аби гліцерин зайнявся, його треба нагріти до значно вищої температури, ніж приміром, етанол. Поясніть, чому.<br> |
| | | | |
| | Отже, метанол, етанол і гліцерин за складом і будовою певною мірою подібні до алканів (поясніть, чим саме), тому, так само як вуглеводні.<br>вступають у реакції повного окиснення (горіння): | | Отже, метанол, етанол і гліцерин за складом і будовою певною мірою подібні до алканів (поясніть, чим саме), тому, так само як вуглеводні.<br>вступають у реакції повного окиснення (горіння): |
| | | | |
| - | СН<sub>3</sub>ОН + 0<sub>2</sub> → С0<sub>2</sub> + Н<sub>2</sub>0; ΔН < 0 <br> | + | СН<sub>3</sub>ОН + 0<sub>2</sub> → С0<sub>2</sub> + Н<sub>2</sub>0; ΔН < 0 <br> |
| | + | |
| | + | С<sub>2</sub>Н<sub>5</sub>ОН + 0<sub>2</sub> → С0<sub>2</sub> + Н<sub>2</sub>0; ΔН < 0 <br> |
| | + | |
| | + | НОСН<sub>2</sub> - СНОН - СН<sub>2</sub>ОН + 0<sub>2</sub> → С0<sub>2</sub> + Н<sub>2</sub>0; ΔН < 0 <br> |
| | | | |
| - | С<sub>2</sub>Н<sub>5</sub>ОН + 0<sub>2</sub> → С0<sub>2</sub> + Н<sub>2</sub>0; ΔН < 0 <br> | + | (скорочено С<sub>3</sub>Н<sub>8</sub>0<sub>3</sub> + 0<sub>2</sub> → С0<sub>2 </sub>+ Н<sub>2</sub><br> |
| | | | |
| - | НОСН<sub>2</sub> - СНОН - СН<sub>2</sub>ОН + 0<sub>2</sub> → С0<sub>2</sub> + Н<sub>2</sub>0; ΔН < 0 <br>
| + | <u>''Завдання<br>''</u> |
| | | | |
| - | (скорочено С<sub>3</sub>Н<sub>8</sub>0<sub>3</sub> + 0<sub>2</sub> → С0<sub>2 </sub>+ Н<sub>2</sub><br>
| + | Перетворіть схеми реакцій повного окиснення спиртів на хімічні рівняння. Визначте, ендо- чи екзотермічними є ці процеси.<br> |
| | | | |
| - | <u>''Завдання<br>''</u>
| + | Наявністю гідроксильної групи й здатністю утворювати водневі зв'язки спирти подібні до води. Тож можна припустити, що, як і вода, вони реагуватимуть з активними металами - калієм, натрієм тощо.<br> |
| | | | |
| - | Перетворіть схеми реакцій повного окиснення спиртів на хімічні рівняння. Визначте, ендо- чи екзотермічними є ці процеси.<br>
| + | <u>''Завдання''</u><br> |
| | | | |
| - | Наявністю гідроксильної групи й здатністю утворювати водневі зв'язки спирти подібні до води. Тож можна припустити, що, як і вода, вони реагуватимуть з активними металами - калієм, натрієм тощо.<br>
| + | Пригадайте, до якого типу належить реакція води з активними металами.<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | Помістімо в маленьку пробірку з абсолютованим (безводним) спиртом кілька шматочків натрію завбільшки із сірникову головку (поясніть, чому спирт не повинен містити домішок води). Спостерігатимемо розігрівання реагуючої суміші, виділення бульбашок безбарвного газу. Це водень, який після перевірки на чистоту, можна підпалити. Після охолодження пробірки можна побачити утворення білого осаду натрій етилату:<br> |
| | | | |
| - | Пригадайте, до якого типу належить реакція води з активними металами.<br>
| + | 2С<sub>2</sub>Н<sub>5</sub>ОН + 2Na → 2С<sub>2</sub>Н<sub>5</sub>ONa + Н<sub>2</sub>↑<br> |
| | | | |
| - | Помістімо в маленьку пробірку з абсолютованим (безводним) спиртом кілька шматочків натрію завбільшки із сірникову головку (поясніть, чому спирт не повинен містити домішок води). Спостерігатимемо розігрівання реагуючої суміші, виділення бульбашок безбарвного газу. Це водень, який після перевірки на чистоту, можна підпалити. Після охолодження пробірки можна побачити утворення білого осаду натрій етилату:<br>
| + | Однак реакція з етанолом відбувається не так активно, як взаємодія натрію з водою.<br> |
| | | | |
| - | 2С<sub>2</sub>Н<sub>5</sub>ОН + 2Na → 2С<sub>2</sub>Н<sub>5</sub>ONa + Н<sub>2</sub>↑<br>
| + | <u>''Завдання''</u><br> |
| | | | |
| - | Однак реакція з етанолом відбувається не так активно, як взаємодія натрію з водою.<br>
| + | Порівняйте склад і будову молекули води і молекули етанолу. Що, на вашу думку, може бути причиною того, що реакція цих сполук з натрієм відбу¬вається з різною інтенсивністю, адже змін в обох випадках зазнає група -ОН?<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | Аналогічно до етанолу відбувається реакція метанолу з натрієм (перетворіть її схему на хімічне рівняння):<br> |
| | | | |
| - | Порівняйте склад і будову молекули води і молекули етанолу. Що, на вашу думку, може бути причиною того, що реакція цих сполук з натрієм відбу¬вається з різною інтенсивністю, адже змін в обох випадках зазнає група -ОН?<br>
| + | СН<sub>3</sub>0H + Nа → СН<sub>3</sub>ONa + Н<sub>2</sub>↑<br> |
| | | | |
| - | Аналогічно до етанолу відбувається реакція метанолу з натрієм (перетворіть її схему на хімічне рівняння):<br>
| + | За об'ємом водню - одного з продуктів реакції - було зроблено висновок, що в молекулах метанолу й етанолу лише один атом Гідрогену заміщується на атом Натрію, а в молекулі гліцерину таких атомів - три:<br> |
| | | | |
| - | СН<sub>3</sub>0H + Nа → СН<sub>3</sub>ONa + Н<sub>2</sub>↑<br>
| + | [[Image:Chemistry_187.jpg]] |
| | | | |
| - | За об'ємом водню - одного з продуктів реакції - було зроблено висновок, що в молекулах метанолу й етанолу лише один атом Гідрогену заміщується на атом Натрію, а в молекулі гліцерину таких атомів - три:<br>
| + | <u>''Завдання''</u><br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | Перетворіть схему реакції гліцерину з натрієм на хімічне рівняння.<br> |
| | | | |
| - | Перетворіть схему реакції гліцерину з натрієм на хімічне рівняння.<br>
| + | Отже, атоми Гідрогену, зв'язані в молекулах спиртів з атомами Оксигену, виявляють вищу хімічну активність порівняно з атомами Гідрогену, безпосередньо сполученими з атомами Карбону.<br> |
| | | | |
| - | Отже, атоми Гідрогену, зв'язані в молекулах спиртів з атомами Оксигену, виявляють вищу хімічну активність порівняно з атомами Гідрогену, безпосередньо сполученими з атомами Карбону.<br>
| + | • ''Якісна реакція на гліцерин'' також пов'язана з наявністю у складі його молекули трьох функціональних груп —OН. З'ясуйте зовнішні ефекти її перебігу, виконавши лабораторний дослід.<br> |
| | | | |
| - | • ''Якісна реакція на гліцерин'' також пов'язана з наявністю у складі його молекули трьох функціональних груп —OН. З'ясуйте зовнішні ефекти її перебігу, виконавши лабораторний дослід.<br>
| + | ЛАБОРАТОРНИЙ ДОСЛІД<br> |
| | | | |
| - | ЛАБОРАТОРНИЙ ДОСЛІД<br>
| + | ''№ 8 (продовження). Якісна реакція на гліцерин''<br> |
| | | | |
| - | ''№ 8 (продовження). Якісна реакція на гліцерин''<br> | + | <u>''Завдання''</u><br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | Дослідіть взаємодію гліцерину з купрум(ІІ) гідроксидом.<br> |
| | | | |
| - | Дослідіть взаємодію гліцерину з купрум(ІІ) гідроксидом.<br>
| + | Обладнання: пробірка. Реактиви: гліцерин; розчини купрум(ІІ) сульфату, натрій гідроксиду.<br> |
| | | | |
| - | Обладнання: пробірка. Реактиви: гліцерин; розчини купрум(ІІ) сульфату, натрій гідроксиду.<br>
| + | Інструкція<br> |
| | | | |
| - | Інструкція<br>
| + | Налийте в пробірку розчин купрум(ІІ) сульфату об'ємом 0,5 мл і добавте концентрований розчин натрій гідроксиду об'ємом 1-2 мл. Які характер та колір осаду, що утворився? До осаду добавте гліцерин об'ємом 1-2 мл. Суміш збовтайте. Чи розчиняється осад? Якого кольору утворений розчин?<br> |
| | | | |
| - | Налийте в пробірку розчин купрум(ІІ) сульфату об'ємом 0,5 мл і добавте концентрований розчин натрій гідроксиду об'ємом 1-2 мл. Які характер та колір осаду, що утворився? До осаду добавте гліцерин об'ємом 1-2 мл. Суміш збовтайте. Чи розчиняється осад? Якого кольору утворений розчин?<br>
| + | Зверніть увагу: рівняння реакції між гліцерином і свіжодобутим купрум(ІІ) гідроксидом ми не розглядаємо через його складність. Найважливіше, аби ви навчилися за допомогою якісної реакції виявляти гліцерин. За допомогою цієї реакції можна виявити й інші органічні сполуки, у молекулах яких є кілька функціональних гідроксильних груп. Про це ви дізнаєтеся, вивчаючи представників вуглеводів.<br> |
| | | | |
| - | Зверніть увагу: рівняння реакції між гліцерином і свіжодобутим купрум(ІІ) гідроксидом ми не розглядаємо через його складність. Найважливіше, аби ви навчилися за допомогою якісної реакції виявляти гліцерин. За допомогою цієї реакції можна виявити й інші органічні сполуки, у молекулах яких є кілька функціональних гідроксильних груп. Про це ви дізнаєтеся, вивчаючи представників вуглеводів.<br>
| + | <u>''Стисло про головне''</u><br> |
| | | | |
| - | <u>''Стисло про головне''</u><br>
| + | Метанол, етанол, гліцерол (гліцерин) - оксигеновмісні органічні сполуки. Суфікс —ол у назвах цих речовин вказує на наявність однієї (чи кількох) груп атомів —ОН.<br> |
| | | | |
| - | Метанол, етанол, гліцерол (гліцерин) - оксигеновмісні органічні сполуки. Суфікс —ол у назвах цих речовин вказує на наявність однієї (чи кількох) груп атомів —ОН.<br> | + | Метанол, етанол, гліцерин - похідні насичених вуглеводнів, тому їх називають насиченими спиртами. Молекули метанолу й етанолу містять по одній гідроксильній групі, отже, ці спирти - одноатомні. У молекулі гліцерину біля кожного з трьох атомів Карбону міститься гідроксильна група. Гліцерин - трьохатомний спирт.<br> |
| | | | |
| - | Метанол, етанол, гліцерин - похідні насичених вуглеводнів, тому їх називають насиченими спиртами. Молекули метанолу й етанолу містять по одній гідроксильній групі, отже, ці спирти - одноатомні. У молекулі гліцерину біля кожного з трьох атомів Карбону міститься гідроксильна група. Гліцерин - трьохатомний спирт.<br> | + | Метанол, етанол і гліцерин добре розчиняються в полярних розчинниках, змішуються з водою в будь-яких співвідношеннях. Під час розчинення метанолу, етанолу й гліцерину між молекулами спиртів й молекулами води утворюються водневі зв'язки.<br> |
| | | | |
| - | Метанол, етанол і гліцерин добре розчиняються в полярних розчинниках, змішуються з водою в будь-яких співвідношеннях. Під час розчинення метанолу, етанолу й гліцерину між молекулами спиртів й молекулами води утворюються водневі зв'язки.<br>
| + | Водневі зв'язки між молекулами спиртів зумовлюють їхні аномально високі порівняно з вуглеводнями температури кипіння. Між молекулами гліцерину утворюється значно більша кількість водневих зв'язків порівняно з метанолом і етанолом, тому температура кипіння гліцерину істотно вища.<br> |
| | | | |
| - | Водневі зв'язки між молекулами спиртів зумовлюють їхні аномально високі порівняно з вуглеводнями температури кипіння. Між молекулами гліцерину утворюється значно більша кількість водневих зв'язків порівняно з метанолом і етанолом, тому температура кипіння гліцерину істотно вища.<br>
| + | В'язкість гліцерину, відсутність у нього запаху та солодкий смак також пов'язані з наявністю в його молекулі трьох гідроксильних груп. Метанол і етанол - леткі речовини з характерним «алкогольним» запахом і «пекучим» смаком. Усі ці рідини безбарвні й прозорі.<br> |
| | | | |
| - | В'язкість гліцерину, відсутність у нього запаху та солодкий смак також пов'язані з наявністю в його молекулі трьох гідроксильних груп. Метанол і етанол - леткі речовини з характерним «алкогольним» запахом і «пекучим» смаком. Усі ці рідини безбарвні й прозорі.<br>
| + | Хімічні властивості метанолу, етанолу й гліцерину також зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти вступають у реакції повного окиснення (горіння):<br> |
| | | | |
| - | Хімічні властивості метанолу, етанолу й гліцерину також зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти вступають у реакції повного окиснення (горіння):<br>
| + | 2СН<sub>3</sub>ОН + 30<sub>2</sub> → 2С0<sub>2 </sub>+ 4Н<sub>2</sub>0; ΔН < 0<br> |
| | | | |
| - | 2СН<sub>3</sub>ОН + 30<sub>2</sub> → 2С0<sub>2 </sub>+ 4Н<sub>2</sub>0; ΔН < 0<br>
| + | С<sub>2</sub>Н<sub>5</sub>ОН + 30<sub>2</sub> → 2С0<sub>2</sub> + ЗН<sub>2</sub>0; ΔН < 0<br> |
| | | | |
| - | С<sub>2</sub>Н<sub>5</sub>ОН + 30<sub>2</sub> → 2С0<sub>2</sub> + ЗН<sub>2</sub>0; ΔН < 0<br>
| + | 2НОСН<sub>2 </sub>- СНОН - СН<sub>2</sub>ОН + 70<sub>2</sub> → 6С0<sub>2</sub> + 8Н<sub>2</sub>0; ΔН < 0<br> |
| | | | |
| - | 2НОСН<sub>2 </sub>- СНОН - СН<sub>2</sub>ОН + 70<sub>2</sub> → 6С0<sub>2</sub> + 8Н<sub>2</sub>0; ΔН < 0<br>
| + | (скорочено 2С<sub>3</sub>Н<sub>8</sub>0<sub>3</sub> + 70<sub>2 </sub>→ 6С0<sub>2</sub> + 8Н<sub>2</sub>0; ΔН < 0<br> |
| | | | |
| - | (скорочено 2С<sub>3</sub>Н<sub>8</sub>0<sub>3</sub> + 70<sub>2 </sub>→ 6С0<sub>2</sub> + 8Н<sub>2</sub>0; ΔН < 0<br>
| + | Метанол й етанол - легкозаймисті речовини й потребують особливо обережного поводження. Метанол, етанол, гліцерин горять майже безбарвним некіптявим полум'ям. Реакції повного окиснення спиртів екзотермічні.<br> |
| | | | |
| - | Метанол й етанол - легкозаймисті речовини й потребують особливо обережного поводження. Метанол, етанол, гліцерин горять майже безбарвним некіптявим полум'ям. Реакції повного окиснення спиртів екзотермічні.<br>
| + | Як і вода, спирти реагують з активними металами - калієм, натрієм тощо: <br> |
| | | | |
| - | Як і вода, спирти реагують з активними металами - калієм, натрієм тощо: <br>
| + | 2СН<sub>3</sub>ОН + 2Na → 2CH<sub>3</sub>ONa + H<sub>2</sub>↑<br> |
| | | | |
| - | 2СН<sub>3</sub>ОН + 2Na → 2CH<sub>3</sub>ONa + H<sub>2</sub>↑<br>
| + | 2С<sub>2</sub>Н<sub>5</sub>ОН + 2Na → 2C<sub>2</sub>H<sub>5</sub>ONa + H<sub>2</sub>↑<br> |
| | | | |
| - | 2С<sub>2</sub>Н<sub>5</sub>ОН + 2Na → 2C<sub>2</sub>H<sub>5</sub>ONa + H<sub>2</sub>↑<br>
| + | [[Image:Chemistry_189.jpg]] |
| | | | |
| - | Атоми Гідрогену, зв'язані в молекулах спиртів з атомами Оксигену, виявляють вищу хімічну активність порівняно з атомами Гідрогену, безпосередньо сполученими з атомами Карбону.<br> | + | Атоми Гідрогену, зв'язані в молекулах спиртів з атомами Оксигену, виявляють вищу хімічну активність порівняно з атомами Гідрогену, безпосередньо сполученими з атомами Карбону.<br> |
| | | | |
| - | Якісна реакція на гліцерин пов'язана з наявністю у складі його молекули трьох функціональних груп —ОН. Унаслідок взаємодії гліцерину із свіжодобутим блакитним осадом купрум(ІІ) гідроксиду утворюється яскраво-синій розчин.<br> | + | Якісна реакція на гліцерин пов'язана з наявністю у складі його молекули трьох функціональних груп —ОН. Унаслідок взаємодії гліцерину із свіжодобутим блакитним осадом купрум(ІІ) гідроксиду утворюється яскраво-синій розчин.<br> |
| | | | |
| - | <u>''Застосуйте свої знання й уміння''</u><br> | + | <u>''Застосуйте свої знання й уміння''</u><br> |
| | | | |
| - | 1. Виберіть кількість спільних електронних пар у молекулі етанолу:<br>А 6; Б8; В 9; Г 13. | + | 1. Виберіть кількість спільних електронних пар у молекулі етанолу:<br>А 6; Б8; В 9; Г 13. |
| | | | |
| - | 2. Виберіть кількість функціональних груп у молекулі гліцерину:<br>А1;Б2;ВЗ;Г4. | + | 2. Виберіть кількість функціональних груп у молекулі гліцерину:<br>А1;Б2;ВЗ;Г4. |
| | | | |
| - | 3. Розташуйте сполуки за зменшенням їхньої температури кипіння:<br>А Етан; Б Метанол; В Гліцерин; Г Пропан; Д Етанол. | + | 3. Розташуйте сполуки за зменшенням їхньої температури кипіння:<br>А Етан; Б Метанол; В Гліцерин; Г Пропан; Д Етанол. |
| | | | |
| - | 4. Виберіть сполуки, між молекулами яких утворюються водневі зв'язки:<br>А Бутан; Б Метанол; В Гліцерин; Г Вода; Д Етилен. | + | 4. Виберіть сполуки, між молекулами яких утворюються водневі зв'язки:<br>А Бутан; Б Метанол; В Гліцерин; Г Вода; Д Етилен. |
| | | | |
| - | 5. Виберіть сполуки з характерним запахом:<br>А Метан; Б Етанол; В Гліцерин; Г Вода; Д Етилен. | + | 5. Виберіть сполуки з характерним запахом:<br>А Метан; Б Етанол; В Гліцерин; Г Вода; Д Етилен. |
| | | | |
| - | 6. Виберіть солодку на смак сполуку:<br>А Метанол; Б Етанол; В Гліцерин; Г Вода; Д Ацетилен. | + | 6. Виберіть солодку на смак сполуку:<br>А Метанол; Б Етанол; В Гліцерин; Г Вода; Д Ацетилен. |
| | | | |
| - | 7. Виберіть характеристики реакції повного окиснення метанолу.<br>А Реакція розкладу; Б Окисно-відновна реакція; В Екзотермічна реакція; Г Оборотна реакція. | + | 7. Виберіть характеристики реакції повного окиснення метанолу.<br>А Реакція розкладу; Б Окисно-відновна реакція; В Екзотермічна реакція; Г Оборотна реакція. |
| | | | |
| - | 8. Поясніть, окисником чи відновником є натрій у реакції з етанолом. | + | 8. Поясніть, окисником чи відновником є натрій у реакції з етанолом. |
| | | | |
| - | 9. Абсолютизацію (зневоднення) етанолу здійснюють за допомогою безводного купрум(ІІ) сульфату. Опишіть зовнішні ефекти, які, на вашу думку, мають супроводжувати цей процес. За потреби зверніться до малюнка 5.3. | + | 9. Абсолютизацію (зневоднення) етанолу здійснюють за допомогою безводного купрум(ІІ) сульфату. Опишіть зовнішні ефекти, які, на вашу думку, мають супроводжувати цей процес. За потреби зверніться до малюнка 5.3. |
| | | | |
| - | 10. Виберіть характеристики реакції гліцерину з натрієм;<br>А Реакція заміщення; Б Окисно-відновна реакція; В Ендотермічна реакція; Г Оборотна реакція. | + | 10. Виберіть характеристики реакції гліцерину з натрієм;<br>А Реакція заміщення; Б Окисно-відновна реакція; В Ендотермічна реакція; Г Оборотна реакція. |
| | | | |
| - | 11. Виберіть реактиви для проведення якісної реакції на гліцерин:<br>А Аргентум(І) нітрат; Б Калій гідроксид; В Купрум(ІІ) сульфат; Г Ферум(ІІІ) гідроксид. | + | 11. Виберіть реактиви для проведення якісної реакції на гліцерин:<br>А Аргентум(І) нітрат; Б Калій гідроксид; В Купрум(ІІ) сульфат; Г Ферум(ІІІ) гідроксид. |
| | | | |
| - | 12. Виберіть зовнішній ефект якісної реакції на гліцерин:<br>А Утворення білого осаду; Б Утворення синього розчину; В Виділення без-барвного газу; Г Поява різкого запаху. | + | 12. Виберіть зовнішній ефект якісної реакції на гліцерин:<br>А Утворення білого осаду; Б Утворення синього розчину; В Виділення без-барвного газу; Г Поява різкого запаху. |
| | | | |
| - | Гліцерин - антифриз. Виготовте водні розчини із масовою часткою гліцерину 5, 10, 15, 20 % тощо. Скористайтеся холодильником, аби визначити, за якої масової частки гліцерину його водний розчин перестає замерзати за певної температури. За результатами дослідження підготуйте презентацію.''<br><br><br>'' | + | Гліцерин - антифриз. Виготовте водні розчини із масовою часткою гліцерину 5, 10, 15, 20 % тощо. Скористайтеся холодильником, аби визначити, за якої масової частки гліцерину його водний розчин перестає замерзати за певної температури. За результатами дослідження підготуйте презентацію.''<br><br><br>'' |
| | | | |
| | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів <br>'' | | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів <br>'' |
Версия 07:53, 8 апреля 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Метанол, етанол, їхні молекулярні, електронні та структурні формули, фізичні властивості. Хімічні властивості
МЕТАНОЛ, ЕТАНОЛ, ЇХНІ МОЛЕКУЛЯРНІ, ЕЛЕКТРОННІ ТА СТРУКТУРНІ ФОРМУЛИ, ФІЗИЧНІ ВЛАСТИВОСТІ. ФУНКЦІОНАЛЬНА ГІДРОКСИЛЬНА ГРУПА. ХІМІЧНІ ВЛАСТИВОСТІ: ПОВНЕ ОКИСНЕННЯ, ВЗАЄМОДІЯ З НАТРІЄМ. ЗАСТОСУВАННЯ МЕТАНОЛУ ТА ЕТАНОЛУ. ОТРУЙНІСТЬ СПИРТІВ, ЇХ ЗГУБНА ДІЯ НА ОРГАНІЗМ ЛЮДИНИ
Метанол, етанол, гліцерин
Після опрацювання § 27 ви зможете:
складати й пояснювати молекулярні, електронні та структурні формули метанолу, етанолу, гліцерину; збирати моделі їхніх молекул; характеризувати склад, структуру, фізичні та хімічні властивості цих сполук; ілюструвати властивості метанолу, етанолу, гліцерину рівняннями хімічних реакцій розрізняти спирти за функціональними ознаками.
На шляху до успіху пригадаємо з вивчених курсів хімії, біології, основ здоров'я:
які хімічні елементи, окрім Карбону, є органогенами; яка валентність Карбону й Оксигену в органічних сполуках; який склад гідроксильної групи, у яких неорганічних сполуках вона трапляється; що таке електронегативність і як утворюється ковалентний полярний зв'язок; що таке водневий зв'язок і як він позначається на властивостях речовин; як і чому змінюється характер горіння вуглеводнів залежно від умісту Карбону; що таке гідрати; які продукту згоряння вуглеводнів і як їх виявляють; як вода реагує з активними металами.
Ви, звичайно, пам'ятаєте (див. § 18), що до складу органічних сполук, окрім Карбону й Гідрогену, може входити також Оксиген. Зокрема, до оксигеновмісних органічних сполук належать спирти - метанол, етанол, гліцерин (у сучасній науковій хімічній літературі вам траплятиметься й інша назва гліцерину - гліцерол). Ви, напевно, звернули увагу на суфікс -ол у назвах цих речовин. Що він означає, на які особливості хімічного складу і будови молекул спиртів вказує? Аби з'ясувати це, розгляньмо моделі, за допомогою яких унаочнюють склад і будову молекул спиртів.
• Молекулярні, електронні та структурні формули метанолу, етанолу, й гліцерину наведені на малюнку 27.1.
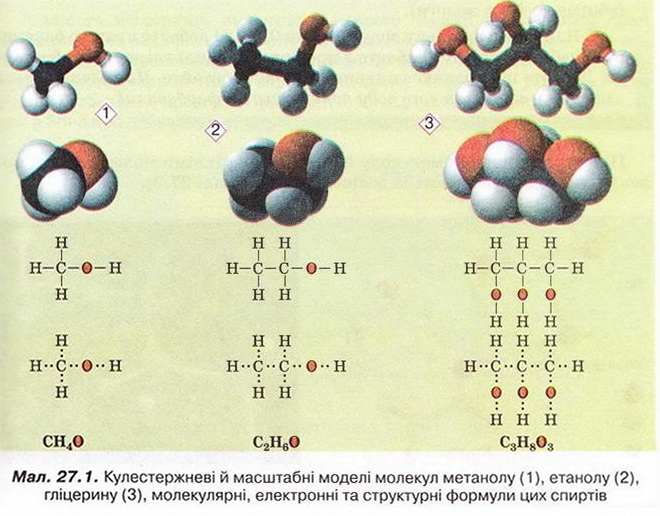
Наявність однієї (чи кількох) груп атомів -ОН є очевидною спільною рисою структур метанолу, етанолу й гліцеролу. Ці речовини можна розглядати як похідні алканів. Приміром, якщо у структурній формулі метану один з чотирьох атомів Гідрогену замінити на гідроксильну групу, дістанемо структурну формулу метанолу. Внаслідок аналогічної дії зі структурною формулою етану одержимо структурну формулу етанолу. Аби зобразити структурну формулу гліцерину, достатньо у структурній формулі пропану замінити на групу -ОН атом Гідрогену біля кожного з трьох атомів Карбону.
Метанол і етанол - похідні насичених вуглеводнів, їхні молекули містять по одній гідроксильній групі. Тому ці спирти називають насиченими одноатомними спиртами. Гліцерол - насичений трьохатомний спирт (поясніть, чому).
Групу - Н називають функціональною групою спиртів - адже вона зумовлює їхні хімічні властивості - здатність вступати в хімічні реакції.
• Фізичні властивості метанолу, етанолу й гліцерину
З огляду на це, не дивно, що метанол, етанол і гліцерин добре розчиняються в полярних розчинниках, передусім воді. З нею вони змішуються в будь-яких співвідношеннях (пригадайте, про це йшлося в § 4-6).
Аби дослідити розчинення гліцерину у воді, виконаймо лабораторний дослід.
ЛАБОРАТОРНИЙ ДОСЛІД
Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ
№ 8. Фізичні властивості гліцерину
Завдання
Дослідіть фізичні властивості гліцерину.
Обладнання: градуйована пробірка або піпетка, пробірка, фільтрувальний папір. Реактиви: гліцерин; чорнило або харчовий водорозчинний барвник, дистильована вода.
Інструкція. 1. Розгляньте гліцерин у склянці, трохи нахиліть її. Чи має гліцерин колір? Чи в'язка ця рідина? Пригадайте прийоми визначення запаху речовин. Відкрийте склянку з гліцерином, визначте, чи має він запах. На аркуш фільтрувального паперу нанесіть краплю гліцерину, на інший аркуш - краплю води. Наприкінці уроку переконайтеся, що папір з водою висох, а з гліцерином став ще вологішим (вбирає до 40 % вологи).
2. Налийте в пробірку воду об'ємом 0,5 мл і добавте краплю барвника. Суміш збовтайте. Добавте в пробірку 2 краплі гліцерину, збовтайте. Добавте ще краплю гліцерину і знову збовтайте. Чи розчиняється гліцерин у воді? Для чого воду попередньо підфарбували?
Під час розчинення метанолу й етанолу між їхніми молекулами й мо¬лекулами води утворюються водневі зв'язки (мал. 27.2).
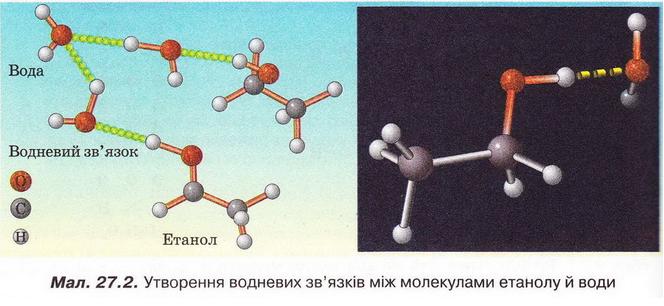
Завдання
За малюнком 27.2 опишіть утворення водневих зв'язків між молекулами етанолу й води. Між якими атомами вони виникають? На якому з них зосереджений частковий позитивний заряд, а на якому - частковий негативний?
Водночас ці спирти, завдяки наявності в їхньому складі неполярних залишків насичених вуглеводнів, розчиняються в слабополярних органічних розчинниках і самі є розчинниками для багатьох неорганічних і органічних речовин.
Температури кипіння (мал. 27.3) метанолу, етанолу й гліцерину значно вищі порівняно з алканами з такою самою кількістю атомів Карбону в ланцюзі. Також впадає в очі різке збільшення температури кипіння трьохатомного спирту гліцерину порівняно з одноатомними спиртами метанолом і етанолом.
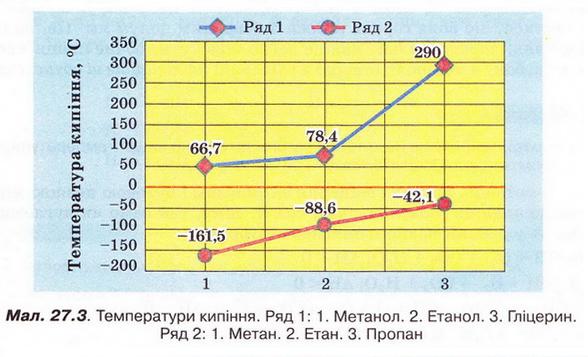
Описані явища пов'язані з утворенням між молекулами спиртів водневих зв'язків (мал. 27.4). На їхнє руйнування треба витратити значну кількість енергії, аби спирт перейшов з рідкого стану в газуватий. Зрозуміло, що між молекулами гліцерину утворюється значно більша кількість водневих зв'язків порівняно з метанолом і етанолом. Тож і температура кипіння гліцерину істотно вища.
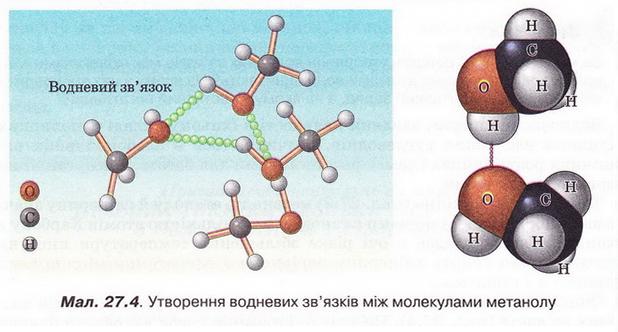
Завдання
За малюнком 27.4 опишіть утворення водневих зв'язків між молекулами метанолу. Між якими атомами виникають водневі зв'язки? На якому з атомів зосереджений частковий позитивний заряд, а на якому - частковий негативний?
В'язкість гліцерину, відсутність у нього запаху та солодкий смак (грецьке glicos означає солодкий) також пов'язані з наявністю в його молекулі трьох гідроксильних груп. Натомість метанол й етанол - леткі речовини з характерним «алкогольним» запахом і «пекучим» смаком. Усі ці рідини безбарвні й прозорі. (Про те, як було відкрито гліцерин ви дізнаєтеся з § 30, а про добування етанолу з природної сировини йтиметься в § 33.)
• Хімічні властивості метанолу, етанолу й гліцерину також зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти беруть участь у найрізноманітніших хімічних перетвореннях, з якими ви матимете нагоду ознайомитися під час вивчення хімії в старшій школі. Розгляньмо дві важливі реакції за участю спиртів і встановімо, чим зумовлений їхній перебіг.
Приклад реакції повного окиснення спиртів ви неодноразово спостерігали під час горіння етанолу в спиртовому пальнику й, напевно, звернули увагу на характерний колір полум'я. Варто пам'ятати, що етанол - легкозаймиста речовина й потребує особливо обережного поводження - адже його пара спалахує за 13 °С. Полум'я метанолу, так саме як і етанолу, некіптяве.
Який характер горіння гліцерину? Можна припустити, що світність його полум'я має бути більшою порівняно з метанолом й етанолом - адже в молекулі гліцерину міститься три атоми Карбону. Експериментальна перевірка спростовує наші припущення. Якщо в тигельку нагріти кипіння гліцерин об'ємом 1 мл й підпалити його пару, можна пересвідчитися, що вона горить майже безбарвним полум'ям. Це, на перший погляд, парадоксальне явище легко пояснити, обчисливши масові частки Карбону в метанолі, етанолі й гліцерині {викопайте ці обчислення).
Завдання
Аби гліцерин зайнявся, його треба нагріти до значно вищої температури, ніж приміром, етанол. Поясніть, чому.
Отже, метанол, етанол і гліцерин за складом і будовою певною мірою подібні до алканів (поясніть, чим саме), тому, так само як вуглеводні.
вступають у реакції повного окиснення (горіння):
СН3ОН + 02 → С02 + Н20; ΔН < 0
С2Н5ОН + 02 → С02 + Н20; ΔН < 0
НОСН2 - СНОН - СН2ОН + 02 → С02 + Н20; ΔН < 0
(скорочено С3Н803 + 02 → С02 + Н2
Завдання
Перетворіть схеми реакцій повного окиснення спиртів на хімічні рівняння. Визначте, ендо- чи екзотермічними є ці процеси.
Наявністю гідроксильної групи й здатністю утворювати водневі зв'язки спирти подібні до води. Тож можна припустити, що, як і вода, вони реагуватимуть з активними металами - калієм, натрієм тощо.
Завдання
Пригадайте, до якого типу належить реакція води з активними металами.
Помістімо в маленьку пробірку з абсолютованим (безводним) спиртом кілька шматочків натрію завбільшки із сірникову головку (поясніть, чому спирт не повинен містити домішок води). Спостерігатимемо розігрівання реагуючої суміші, виділення бульбашок безбарвного газу. Це водень, який після перевірки на чистоту, можна підпалити. Після охолодження пробірки можна побачити утворення білого осаду натрій етилату:
2С2Н5ОН + 2Na → 2С2Н5ONa + Н2↑
Однак реакція з етанолом відбувається не так активно, як взаємодія натрію з водою.
Завдання
Порівняйте склад і будову молекули води і молекули етанолу. Що, на вашу думку, може бути причиною того, що реакція цих сполук з натрієм відбу¬вається з різною інтенсивністю, адже змін в обох випадках зазнає група -ОН?
Аналогічно до етанолу відбувається реакція метанолу з натрієм (перетворіть її схему на хімічне рівняння):
СН30H + Nа → СН3ONa + Н2↑
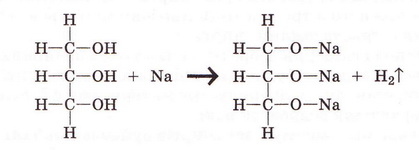
За об'ємом водню - одного з продуктів реакції - було зроблено висновок, що в молекулах метанолу й етанолу лише один атом Гідрогену заміщується на атом Натрію, а в молекулі гліцерину таких атомів - три:
Завдання
Перетворіть схему реакції гліцерину з натрієм на хімічне рівняння.
Отже, атоми Гідрогену, зв'язані в молекулах спиртів з атомами Оксигену, виявляють вищу хімічну активність порівняно з атомами Гідрогену, безпосередньо сполученими з атомами Карбону.
• Якісна реакція на гліцерин також пов'язана з наявністю у складі його молекули трьох функціональних груп —OН. З'ясуйте зовнішні ефекти її перебігу, виконавши лабораторний дослід.
ЛАБОРАТОРНИЙ ДОСЛІД
№ 8 (продовження). Якісна реакція на гліцерин
Завдання
Дослідіть взаємодію гліцерину з купрум(ІІ) гідроксидом.
Обладнання: пробірка. Реактиви: гліцерин; розчини купрум(ІІ) сульфату, натрій гідроксиду.
Інструкція
Налийте в пробірку розчин купрум(ІІ) сульфату об'ємом 0,5 мл і добавте концентрований розчин натрій гідроксиду об'ємом 1-2 мл. Які характер та колір осаду, що утворився? До осаду добавте гліцерин об'ємом 1-2 мл. Суміш збовтайте. Чи розчиняється осад? Якого кольору утворений розчин?
Зверніть увагу: рівняння реакції між гліцерином і свіжодобутим купрум(ІІ) гідроксидом ми не розглядаємо через його складність. Найважливіше, аби ви навчилися за допомогою якісної реакції виявляти гліцерин. За допомогою цієї реакції можна виявити й інші органічні сполуки, у молекулах яких є кілька функціональних гідроксильних груп. Про це ви дізнаєтеся, вивчаючи представників вуглеводів.
Стисло про головне
Метанол, етанол, гліцерол (гліцерин) - оксигеновмісні органічні сполуки. Суфікс —ол у назвах цих речовин вказує на наявність однієї (чи кількох) груп атомів —ОН.
Метанол, етанол, гліцерин - похідні насичених вуглеводнів, тому їх називають насиченими спиртами. Молекули метанолу й етанолу містять по одній гідроксильній групі, отже, ці спирти - одноатомні. У молекулі гліцерину біля кожного з трьох атомів Карбону міститься гідроксильна група. Гліцерин - трьохатомний спирт.
Метанол, етанол і гліцерин добре розчиняються в полярних розчинниках, змішуються з водою в будь-яких співвідношеннях. Під час розчинення метанолу, етанолу й гліцерину між молекулами спиртів й молекулами води утворюються водневі зв'язки.
Водневі зв'язки між молекулами спиртів зумовлюють їхні аномально високі порівняно з вуглеводнями температури кипіння. Між молекулами гліцерину утворюється значно більша кількість водневих зв'язків порівняно з метанолом і етанолом, тому температура кипіння гліцерину істотно вища.
В'язкість гліцерину, відсутність у нього запаху та солодкий смак також пов'язані з наявністю в його молекулі трьох гідроксильних груп. Метанол і етанол - леткі речовини з характерним «алкогольним» запахом і «пекучим» смаком. Усі ці рідини безбарвні й прозорі.
Хімічні властивості метанолу, етанолу й гліцерину також зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти вступають у реакції повного окиснення (горіння):
2СН3ОН + 302 → 2С02 + 4Н20; ΔН < 0
С2Н5ОН + 302 → 2С02 + ЗН20; ΔН < 0
2НОСН2 - СНОН - СН2ОН + 702 → 6С02 + 8Н20; ΔН < 0
(скорочено 2С3Н803 + 702 → 6С02 + 8Н20; ΔН < 0
Метанол й етанол - легкозаймисті речовини й потребують особливо обережного поводження. Метанол, етанол, гліцерин горять майже безбарвним некіптявим полум'ям. Реакції повного окиснення спиртів екзотермічні.
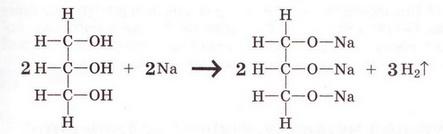
Як і вода, спирти реагують з активними металами - калієм, натрієм тощо:
2СН3ОН + 2Na → 2CH3ONa + H2↑
2С2Н5ОН + 2Na → 2C2H5ONa + H2↑
Атоми Гідрогену, зв'язані в молекулах спиртів з атомами Оксигену, виявляють вищу хімічну активність порівняно з атомами Гідрогену, безпосередньо сполученими з атомами Карбону.
Якісна реакція на гліцерин пов'язана з наявністю у складі його молекули трьох функціональних груп —ОН. Унаслідок взаємодії гліцерину із свіжодобутим блакитним осадом купрум(ІІ) гідроксиду утворюється яскраво-синій розчин.
Застосуйте свої знання й уміння
1. Виберіть кількість спільних електронних пар у молекулі етанолу:
А 6; Б8; В 9; Г 13.
2. Виберіть кількість функціональних груп у молекулі гліцерину:
А1;Б2;ВЗ;Г4.
3. Розташуйте сполуки за зменшенням їхньої температури кипіння:
А Етан; Б Метанол; В Гліцерин; Г Пропан; Д Етанол.
4. Виберіть сполуки, між молекулами яких утворюються водневі зв'язки:
А Бутан; Б Метанол; В Гліцерин; Г Вода; Д Етилен.
5. Виберіть сполуки з характерним запахом:
А Метан; Б Етанол; В Гліцерин; Г Вода; Д Етилен.
6. Виберіть солодку на смак сполуку:
А Метанол; Б Етанол; В Гліцерин; Г Вода; Д Ацетилен.
7. Виберіть характеристики реакції повного окиснення метанолу.
А Реакція розкладу; Б Окисно-відновна реакція; В Екзотермічна реакція; Г Оборотна реакція.
8. Поясніть, окисником чи відновником є натрій у реакції з етанолом.
9. Абсолютизацію (зневоднення) етанолу здійснюють за допомогою безводного купрум(ІІ) сульфату. Опишіть зовнішні ефекти, які, на вашу думку, мають супроводжувати цей процес. За потреби зверніться до малюнка 5.3.
10. Виберіть характеристики реакції гліцерину з натрієм;
А Реакція заміщення; Б Окисно-відновна реакція; В Ендотермічна реакція; Г Оборотна реакція.
11. Виберіть реактиви для проведення якісної реакції на гліцерин:
А Аргентум(І) нітрат; Б Калій гідроксид; В Купрум(ІІ) сульфат; Г Ферум(ІІІ) гідроксид.
12. Виберіть зовнішній ефект якісної реакції на гліцерин:
А Утворення білого осаду; Б Утворення синього розчину; В Виділення без-барвного газу; Г Поява різкого запаху.
Гліцерин - антифриз. Виготовте водні розчини із масовою часткою гліцерину 5, 10, 15, 20 % тощо. Скористайтеся холодильником, аби визначити, за якої масової частки гліцерину його водний розчин перестає замерзати за певної температури. За результатами дослідження підготуйте презентацію.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Матеріали з хімії, завдання та відповіді по класам, плани конспектів уроків з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
















