|
|
|
| Строка 3: |
Строка 3: |
| | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Відношення об’ємів газів у хімічних реакціях.</metakeywords>ВІДНОШЕННЯ ОБ'ЄМІВ ГАЗІВ У ХІМІЧНИХ РЕАКЦІЯХ | | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Відношення об’ємів газів у хімічних реакціях.</metakeywords>ВІДНОШЕННЯ ОБ'ЄМІВ ГАЗІВ У ХІМІЧНИХ РЕАКЦІЯХ |
| | | | |
| - | <br> | + | <br> |
| | | | |
| - | <u>Відношення об'ємів газів у хімічних реакціях</u><br> | + | <u>Відношення об'ємів газів у хімічних реакціях</u><br> |
| | | | |
| - | Після опрацювання § 21 ви зможете:<br> | + | Після опрацювання § 21 ви зможете:<br> |
| | | | |
| - | обчислювати відношення об'ємів газів у хімічних реакціях. <br> | + | обчислювати відношення об'ємів газів у хімічних реакціях. <br> |
| | | | |
| - | На шляху до успіху пригадаємо з вивчених курсів хімії:<br> | + | На шляху до успіху пригадаємо з вивчених курсів хімії:<br> |
| | | | |
| - | що таке молярний об'єм газів; яке формулювання закону Авогадро; як обчислюють об'єм газу за стандартних умов; що показують коефіцієнти в хімічних рівняннях; які співвідношення існують між масою, молярною масою, об'ємом і молярним об'ємом газуватих речовин.<br> | + | що таке молярний об'єм газів; яке формулювання закону Авогадро; як обчислюють об'єм газу за стандартних умов; що показують коефіцієнти в хімічних рівняннях; які співвідношення існують між масою, молярною масою, об'ємом і молярним об'ємом газуватих речовин.<br> |
| | | | |
| - | • ''Відношення об'ємів газів у хімічних реакціях'' вивчало чимало науковців. Адже вимірювати об'єми газів набагато простіше, ніж їхні маси. Приміром, А.Л. Лавуазьє (мал. 21.1) робив спроби визначити співвідношення між об'ємами водню та кисню у реакції синтезу води. К. Бертолле (мал. 21.2) вивчав співвідношення між об'ємами водню і азоту в реакції розкладання амоніаку - леткої сполуки Нітрогену з Гідрогеном.<br> | + | • ''Відношення об'ємів газів у хімічних реакціях'' вивчало чимало науковців. Адже вимірювати об'єми газів набагато простіше, ніж їхні маси. Приміром, А.Л. Лавуазьє (мал. 21.1) робив спроби визначити співвідношення між об'ємами водню та кисню у реакції синтезу води. К. Бертолле (мал. 21.2) вивчав співвідношення між об'ємами водню і азоту в реакції розкладання амоніаку - леткої сполуки Нітрогену з Гідрогеном.<br> |
| | | | |
| - | [[Image:Chemistry_142.jpg]] | + | [[Image:Chemistry 142.jpg]] |
| | | | |
| - | 1805 p. Жозе Луї Гей-Люссак (мал. 21.3) і Олександр фон Гумбольдт (мал. 21.4), вивчаючи співвідношення об'ємів газів у хімічних реакціях дослідним шляхом установили, що у реакції синтезу води з простих речовин об'єм водню вдвічі більший за об'єм кисню й дорівнює об'ємові продукту реакції - водяної пари (мал. 21.5).<br> | + | 1805 p. Жозе Луї Гей-Люссак (мал. 21.3) і Олександр фон Гумбольдт (мал. 21.4), вивчаючи співвідношення об'ємів газів у хімічних реакціях дослідним шляхом установили, що у реакції синтезу води з простих речовин об'єм водню вдвічі більший за об'єм кисню й дорівнює об'ємові продукту реакції - водяної пари (мал. 21.5).<br> |
| | | | |
| - | [[Image:Chemistry_143.jpg]] | + | [[Image:Chemistry 143.jpg]] |
| | | | |
| - | [[Image:Chemistry_143_1.jpg]] | + | [[Image:Chemistry 143 1.jpg]] |
| | | | |
| - | Ж.Л. Гей-Люссак продовжив вивчення відношень об'ємів газів у хімічних реакціях. Здобуті експериментальні дані науковець узагальнив у законі об'ємних відношень: за однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою їх невеликі цілі числа. Результати дослідженні він опублікував 1808 р. у статті «Про сполучення газоподібних тіл одне з одним».<br> | + | Ж.Л. Гей-Люссак продовжив вивчення відношень об'ємів газів у хімічних реакціях. Здобуті експериментальні дані науковець узагальнив у законі об'ємних відношень: за однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою їх невеликі цілі числа. Результати дослідженні він опублікував 1808 р. у статті «Про сполучення газоподібних тіл одне з одним».<br> |
| | | | |
| - | Згодом виявилося, що ці «невеликі цілі числа» - не що інше, як коефіцієнти у рівняннях хімічних реакцій за участю газуватих речовин. Спробуймо пояснити це з огляду на закон Авогадро (пригадайте його формулювання).<br> | + | Згодом виявилося, що ці «невеликі цілі числа» - не що інше, як коефіцієнти у рівняннях хімічних реакцій за участю газуватих речовин. Спробуймо пояснити це з огляду на закон Авогадро (пригадайте його формулювання).<br> |
| | | | |
| - | Ви, звичайно, розумієте, що хімічне рівняння описує одиничний акт реакції. Приміром, в одиничному акті синтезу води беруть участь дві молекули водню і одна молекула кисню мал. 21.6).<br> | + | Ви, звичайно, розумієте, що хімічне рівняння описує одиничний акт реакції. Приміром, в одиничному акті синтезу води беруть участь дві молекули водню і одна молекула кисню мал. 21.6).<br> |
| | | | |
| - | [[Image:Chemistry_143_2.jpg]] | + | [[Image:Chemistry 143 2.jpg]] |
| | | | |
| - | Продукт їхньої взаємодії - дві молекули води. Аби обидва реагенти витратилися повністю, потрібно, щоб кількість молекул водню була вдвічі більша за кількість молекул кисню. Оскільки в рівних об'ємах різних газів за однакових умов містяться однакові кількості молекул, можна стверджувати, що об'єм водню в реакції має вдвічі перевищувати об'єм кисню. А об'єм продукту реакції - водяної пари - дорівнюватиме об'єму водню й буде вдвічі більший за об'єм кисню (мал. 21.7).<br> | + | Продукт їхньої взаємодії - дві молекули води. Аби обидва реагенти витратилися повністю, потрібно, щоб кількість молекул водню була вдвічі більша за кількість молекул кисню. Оскільки в рівних об'ємах різних газів за однакових умов містяться однакові кількості молекул, можна стверджувати, що об'єм водню в реакції має вдвічі перевищувати об'єм кисню. А об'єм продукту реакції - водяної пари - дорівнюватиме об'єму водню й буде вдвічі більший за об'єм кисню (мал. 21.7).<br> |
| | | | |
| - | [[Image:Chemistry_144.jpg]] | + | [[Image:Chemistry 144.jpg]] |
| | | | |
| - | Дослідження Гей-Люссака та відкриті ним закономірності стали вагомим внеском у розвиток уявлень про атоми й молекули. Зокрема, було зроблено висновки про те, що молекули водню, кисню, азоту, хлору тощо двохатомні. Якби, приміром, молекули водню й хлору були одноатомними то об'єм утвореного гідроген хлориду мав би бути такий самий, як об'єм водню (або хлору). Експериментально було визначено, що об’єм гідроген хлориду вдвічі більший за об'єм кожного з реагентів, тобто рівняння реакції таке:<br> | + | Дослідження Гей-Люссака та відкриті ним закономірності стали вагомим внеском у розвиток уявлень про атоми й молекули. Зокрема, було зроблено висновки про те, що молекули водню, кисню, азоту, хлору тощо двохатомні. Якби, приміром, молекули водню й хлору були одноатомними то об'єм утвореного гідроген хлориду мав би бути такий самий, як об'єм водню (або хлору). Експериментально було визначено, що об’єм гідроген хлориду вдвічі більший за об'єм кожного з реагентів, тобто рівняння реакції таке:<br> |
| | | | |
| - | Н<sub>2</sub> + Сl<sub>2 </sub>= 2НСl<br> | + | Н<sub>2</sub> + Сl<sub>2 </sub>= 2НСl<br> |
| | | | |
| - | Проаналізуймо з огляду на відношення об'ємів газів у хімічних реакціях процес горіння метану. З хімічного рівняння<br> | + | Проаналізуймо з огляду на відношення об'ємів газів у хімічних реакціях процес горіння метану. З хімічного рівняння<br> |
| | | | |
| - | СН<sub>4</sub> + 20<sub>2 </sub>С0<sub>2 </sub>+ 2Н<sub>2</sub>0<br> | + | СН<sub>4</sub> + 20<sub>2 </sub>С0<sub>2 </sub>+ 2Н<sub>2</sub>0<br> |
| | | | |
| - | очевидними є співвідношення між об'ємами газуватих реагентів і продуктів реакції:<br> | + | очевидними є співвідношення між об'ємами газуватих реагентів і продуктів реакції:<br> |
| | | | |
| - | V(CH<sub>4</sub>): V(0<sub>2</sub>) : V(C0<sub>2</sub>): V(Н<sub>2</sub>0) = 1:2:1:2<br> | + | V(CH<sub>4</sub>): V(0<sub>2</sub>) : V(C0<sub>2</sub>): V(Н<sub>2</sub>0) = 1:2:1:2<br> |
| | | | |
| - | <u>''Розв'яжімо задачі''</u><br> | + | <u>''Розв'яжімо задачі''</u><br> |
| | | | |
| - | 1. На опалювання будинку об'ємом 100 м3 за місяць витрачають метая об'ємом 350 м3. Обчисліть об'єм кисню, який потрібен для згоряння цієї порції метану, та об'єми продуктів реакції (об'єми газуватих реагентів продуктів виміряно за однакових умов). | + | 1. На опалювання будинку об'ємом 100 м3 за місяць витрачають метая об'ємом 350 м3. Обчисліть об'єм кисню, який потрібен для згоряння цієї порції метану, та об'єми продуктів реакції (об'єми газуватих реагентів продуктів виміряно за однакових умов). |
| | | | |
| - | [[Image:Chemistry_144_1.jpg]] | + | [[Image:Chemistry_144_1x.jpg]]<br> |
| | | | |
| - | Відповідь. На згоряння метану об'ємом 350 м3 витратиться кисеи об'ємом 700 м3. Унаслідок цього утвориться карбон(ІV) оксид об'ємом 350 м3 і водяна пара об'ємом 700 м3. | + | Відповідь. На згоряння метану об'ємом 350 м3 витратиться кисеи об'ємом 700 м3. Унаслідок цього утвориться карбон(ІV) оксид об'ємом 350 м3 і водяна пара об'ємом 700 м3. |
| | | | |
| - | 2. Визначте, чи вистачить хлору об'ємом 120 л на повне хлорування метану об'ємом 25 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов). | + | 2. Визначте, чи вистачить хлору об'ємом 120 л на повне хлорування метану об'ємом 25 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов). |
| | | | |
| - | [[Image:Chemistry_145.jpg]] | + | [[Image:Chemistry 145.jpg]] |
| | | | |
| - | Відповідь. Оскільки на повне хлорування метану витратиться хлор об’ємом 100 л, то зазначеної в умові кількості хлору вистачить для проведення реакції. | + | Відповідь. Оскільки на повне хлорування метану витратиться хлор об’ємом 100 л, то зазначеної в умові кількості хлору вистачить для проведення реакції. |
| | | | |
| - | 3. Для синтезу гідроген хлориду було взято хлор об'ємом 5 л і водень об'ємом 8 л. Визначте об'ємний склад газової суміші, яка утвориться після реакції (об'єми газуватих реагентів і продуктів виміряно за однакових умов). | + | 3. Для синтезу гідроген хлориду було взято хлор об'ємом 5 л і водень об'ємом 8 л. Визначте об'ємний склад газової суміші, яка утвориться після реакції (об'єми газуватих реагентів і продуктів виміряно за однакових умов). |
| | | | |
| - | Цю задачу розв'яжімо усно, використовуючи наведене у параграфі хімічне рівняння синтезу гідроген хлориду. З нього очевидно, що з хлором об'ємом 5 л прореагує водень такого самого об'єму. Отже, водень об'ємом 3 л не братиме участі у реакції. Об'єм утвореного гідроген хлориду вдвічі більшим за об'єм хлору і становитиме 10 л. Тобто газова суміш після закінчення реакції міститиме гідроген хлорид об'ємом 10 л і водень об'ємом 3 л. | + | Цю задачу розв'яжімо усно, використовуючи наведене у параграфі хімічне рівняння синтезу гідроген хлориду. З нього очевидно, що з хлором об'ємом 5 л прореагує водень такого самого об'єму. Отже, водень об'ємом 3 л не братиме участі у реакції. Об'єм утвореного гідроген хлориду вдвічі більшим за об'єм хлору і становитиме 10 л. Тобто газова суміш після закінчення реакції міститиме гідроген хлорид об'ємом 10 л і водень об'ємом 3 л. |
| | | | |
| - | Уміння використовувати відношення об'ємів газів для обчислень за хімічними рівняннями знадобиться вам під час подальшого вивчення органічних і неорганічних речовин. У промисловості ці вміння необхідні для розрахунків об'ємів газуватих реагентів і продуктів реакцій.<u</u> | + | Уміння використовувати відношення об'ємів газів для обчислень за хімічними рівняннями знадобиться вам під час подальшого вивчення органічних і неорганічних речовин. У промисловості ці вміння необхідні для розрахунків об'ємів газуватих реагентів і продуктів реакцій.<u</u> |
| | | | |
| - | <u>''Стисло про головне''</u> | + | <u>''Стисло про головне''</u> |
| | | | |
| - | Відношення об'ємів газів у хімічних реакціях вивчало чимало науковців. Адже вимірювати об'єми газів набагато простіше, ніж їхні маси. Здобуті разом з О. Гумбольдтом експериментальні дані Ж.Л. Гей-Люссак узагальнив у законі об'ємних відношень: за однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою як невеликі цілі числа. | + | Відношення об'ємів газів у хімічних реакціях вивчало чимало науковців. Адже вимірювати об'єми газів набагато простіше, ніж їхні маси. Здобуті разом з О. Гумбольдтом експериментальні дані Ж.Л. Гей-Люссак узагальнив у законі об'ємних відношень: за однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою як невеликі цілі числа. |
| | | | |
| - | Дослідження Гей-Люссака та відкриті ним закономірності стали вагомим внеском у розвиток уявлень про атоми й молекули. | + | Дослідження Гей-Люссака та відкриті ним закономірності стали вагомим внеском у розвиток уявлень про атоми й молекули. |
| | | | |
| - | <u>''Застосуйте свої знання й уміння''</u> | + | <u>''Застосуйте свої знання й уміння''</u> |
| | | | |
| | 1. Виберіть правильне доповнення твердження. За однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою як:<br>А Невеликі цілі числа; Б Цілі числа, кратні десяти; В Дробові числа, кратні числу Авогадро; Г Індекси у хімічних формулах. | | 1. Виберіть правильне доповнення твердження. За однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою як:<br>А Невеликі цілі числа; Б Цілі числа, кратні десяти; В Дробові числа, кратні числу Авогадро; Г Індекси у хімічних формулах. |
| | | | |
| - | 2. Виберіть об'єм (л) водню, який витратився у реакції з киснем, якщо продукт взаємодії - водяна пара об'ємом 300 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):<br>А 150; Б 300; В 450; Г 600. | + | 2. Виберіть об'єм (л) водню, який витратився у реакції з киснем, якщо продукт взаємодії - водяна пара об'ємом 300 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):<br>А 150; Б 300; В 450; Г 600. |
| | | | |
| - | 3. Виберіть об'єм (л) хлору, витраченого на повне хлорування метану, якщо один з продуктів реакції - гідроген хлорид об'ємом 40 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):<br>А 20; Б 40; В 80; Г 160. | + | 3. Виберіть об'єм (л) хлору, витраченого на повне хлорування метану, якщо один з продуктів реакції - гідроген хлорид об'ємом 40 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):<br>А 20; Б 40; В 80; Г 160. |
| | | | |
| - | 4. Виберіть об'єм (л) метану, на повне хлорування якого було витрачено хлор об'ємом 16л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):<br>А4; Б8; В 16; Г32. | + | 4. Виберіть об'єм (л) метану, на повне хлорування якого було витрачено хлор об'ємом 16л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):<br>А4; Б8; В 16; Г32. |
| | | | |
| - | 5. Для синтезу гідроген хлориду було взято хлор об'ємом 0,4 л і водень об'ємом 0,2 л. Визначте об'ємний склад газової суміші, яка утвориться після реакції (об'єми газуватих реагентів і продуктів виміряно за однакових умов). | + | 5. Для синтезу гідроген хлориду було взято хлор об'ємом 0,4 л і водень об'ємом 0,2 л. Визначте об'ємний склад газової суміші, яка утвориться після реакції (об'єми газуватих реагентів і продуктів виміряно за однакових умов). |
| | | | |
| - | 6. Виберіть об'єм (л) гідроген хлориду, який утворився на першій стадії хлорування метану об'ємом 6 л (об'єми газуватих реагентів і продуктів виміряне за однакових умов):<br>А 6; Б 12; В 18; Г 24. | + | 6. Виберіть об'єм (л) гідроген хлориду, який утворився на першій стадії хлорування метану об'ємом 6 л (об'єми газуватих реагентів і продуктів виміряне за однакових умов):<br>А 6; Б 12; В 18; Г 24. |
| | | | |
| - | 7. У побутовому газовому котлі з бойлером витрати метану становлять 4,38 м3/год. Обчисліть об'єм вуглекислого газу, який утвориться внаслідок безперервної роботи котла упродовж доби (об'єми газуватих реагентів і продуктів виміряно за однакових умов). | + | 7. У побутовому газовому котлі з бойлером витрати метану становлять 4,38 м3/год. Обчисліть об'єм вуглекислого газу, який утвориться внаслідок безперервної роботи котла упродовж доби (об'єми газуватих реагентів і продуктів виміряно за однакових умов). |
| | | | |
| - | 8. У газовому котлі витрати метану становлять 0,9 м3/год. Обчисліть об'єм кисню, який витрачається внаслідок безперервної роботи котла упродовж 5 годин (об'єми газуватих реагентів і продуктів виміряно за однакових умов). | + | 8. У газовому котлі витрати метану становлять 0,9 м3/год. Обчисліть об'єм кисню, який витрачається внаслідок безперервної роботи котла упродовж 5 годин (об'єми газуватих реагентів і продуктів виміряно за однакових умов). |
| | | | |
| - | 9. *Позашляховик, який працює на водневому паливі, витрачає водень масок: 4,2 кг на 320 км пробігу. Водень міститься у вуглепластиковому балоні під тиском до 700 атм. За нормальних умов об'єм цієї порції водню становив би 47,04 м3. Обчисліть об'єм кисню (н. у.), який витрачається на подолань цим автомобілем шляху завдовжки 960 км (об'єми газуватих реагентів продуктів виміряно за однакових умов). | + | 9. *Позашляховик, який працює на водневому паливі, витрачає водень масок: 4,2 кг на 320 км пробігу. Водень міститься у вуглепластиковому балоні під тиском до 700 атм. За нормальних умов об'єм цієї порції водню становив би 47,04 м3. Обчисліть об'єм кисню (н. у.), який витрачається на подолань цим автомобілем шляху завдовжки 960 км (об'єми газуватих реагентів продуктів виміряно за однакових умов). |
| | | | |
| - | <u>''Скарбничка досвіду''</u> | + | <u>''Скарбничка досвіду''</u> |
| | | | |
| - | Роздивіться марку, зображену на малюнку 21.8. | + | Роздивіться марку, зображену на малюнку 21.8. |
| | | | |
| - | [[Image:Chemistry_146.jpg]] | + | [[Image:Chemistry 146.jpg]] |
| | | | |
| - | Дізнайтеся, якій події вона присвячена Портрет якого науковця, що теж брав участь у цьому дослідженні, не потрапив на марку? Для чого дослідники взяли із собою термометр, барометр та скляні бутлі з добре притертими пробками? Яких висновків дійшли вчені на основі здобутих результатів? Підготуйте повідомлення про життя й наукові здобутки вченого, зображеного на марці. | + | Дізнайтеся, якій події вона присвячена Портрет якого науковця, що теж брав участь у цьому дослідженні, не потрапив на марку? Для чого дослідники взяли із собою термометр, барометр та скляні бутлі з добре притертими пробками? Яких висновків дійшли вчені на основі здобутих результатів? Підготуйте повідомлення про життя й наукові здобутки вченого, зображеного на марці. |
| | | | |
| | ''<br>Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | | ''<br>Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' |
Версия 16:42, 7 апреля 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Відношення об’ємів газів у хімічних реакціях
ВІДНОШЕННЯ ОБ'ЄМІВ ГАЗІВ У ХІМІЧНИХ РЕАКЦІЯХ
Відношення об'ємів газів у хімічних реакціях
Після опрацювання § 21 ви зможете:
обчислювати відношення об'ємів газів у хімічних реакціях.
На шляху до успіху пригадаємо з вивчених курсів хімії:
що таке молярний об'єм газів; яке формулювання закону Авогадро; як обчислюють об'єм газу за стандартних умов; що показують коефіцієнти в хімічних рівняннях; які співвідношення існують між масою, молярною масою, об'ємом і молярним об'ємом газуватих речовин.
• Відношення об'ємів газів у хімічних реакціях вивчало чимало науковців. Адже вимірювати об'єми газів набагато простіше, ніж їхні маси. Приміром, А.Л. Лавуазьє (мал. 21.1) робив спроби визначити співвідношення між об'ємами водню та кисню у реакції синтезу води. К. Бертолле (мал. 21.2) вивчав співвідношення між об'ємами водню і азоту в реакції розкладання амоніаку - леткої сполуки Нітрогену з Гідрогеном.

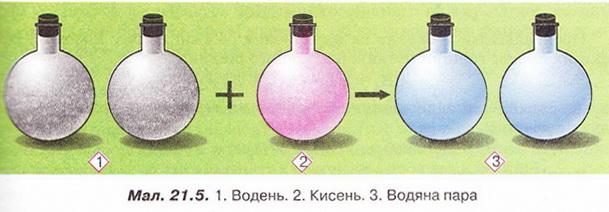
1805 p. Жозе Луї Гей-Люссак (мал. 21.3) і Олександр фон Гумбольдт (мал. 21.4), вивчаючи співвідношення об'ємів газів у хімічних реакціях дослідним шляхом установили, що у реакції синтезу води з простих речовин об'єм водню вдвічі більший за об'єм кисню й дорівнює об'ємові продукту реакції - водяної пари (мал. 21.5).

Ж.Л. Гей-Люссак продовжив вивчення відношень об'ємів газів у хімічних реакціях. Здобуті експериментальні дані науковець узагальнив у законі об'ємних відношень: за однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою їх невеликі цілі числа. Результати дослідженні він опублікував 1808 р. у статті «Про сполучення газоподібних тіл одне з одним».
Згодом виявилося, що ці «невеликі цілі числа» - не що інше, як коефіцієнти у рівняннях хімічних реакцій за участю газуватих речовин. Спробуймо пояснити це з огляду на закон Авогадро (пригадайте його формулювання).
Ви, звичайно, розумієте, що хімічне рівняння описує одиничний акт реакції. Приміром, в одиничному акті синтезу води беруть участь дві молекули водню і одна молекула кисню мал. 21.6).
Продукт їхньої взаємодії - дві молекули води. Аби обидва реагенти витратилися повністю, потрібно, щоб кількість молекул водню була вдвічі більша за кількість молекул кисню. Оскільки в рівних об'ємах різних газів за однакових умов містяться однакові кількості молекул, можна стверджувати, що об'єм водню в реакції має вдвічі перевищувати об'єм кисню. А об'єм продукту реакції - водяної пари - дорівнюватиме об'єму водню й буде вдвічі більший за об'єм кисню (мал. 21.7).
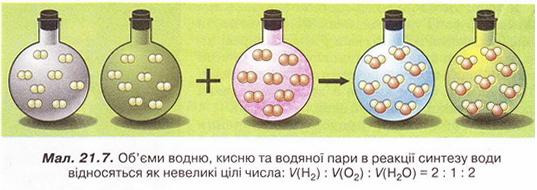
Дослідження Гей-Люссака та відкриті ним закономірності стали вагомим внеском у розвиток уявлень про атоми й молекули. Зокрема, було зроблено висновки про те, що молекули водню, кисню, азоту, хлору тощо двохатомні. Якби, приміром, молекули водню й хлору були одноатомними то об'єм утвореного гідроген хлориду мав би бути такий самий, як об'єм водню (або хлору). Експериментально було визначено, що об’єм гідроген хлориду вдвічі більший за об'єм кожного з реагентів, тобто рівняння реакції таке:
Н2 + Сl2 = 2НСl
Проаналізуймо з огляду на відношення об'ємів газів у хімічних реакціях процес горіння метану. З хімічного рівняння
СН4 + 202 С02 + 2Н20
очевидними є співвідношення між об'ємами газуватих реагентів і продуктів реакції:
V(CH4): V(02) : V(C02): V(Н20) = 1:2:1:2
Розв'яжімо задачі
1. На опалювання будинку об'ємом 100 м3 за місяць витрачають метая об'ємом 350 м3. Обчисліть об'єм кисню, який потрібен для згоряння цієї порції метану, та об'єми продуктів реакції (об'єми газуватих реагентів продуктів виміряно за однакових умов).

Відповідь. На згоряння метану об'ємом 350 м3 витратиться кисеи об'ємом 700 м3. Унаслідок цього утвориться карбон(ІV) оксид об'ємом 350 м3 і водяна пара об'ємом 700 м3.
2. Визначте, чи вистачить хлору об'ємом 120 л на повне хлорування метану об'ємом 25 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов).

Відповідь. Оскільки на повне хлорування метану витратиться хлор об’ємом 100 л, то зазначеної в умові кількості хлору вистачить для проведення реакції.
3. Для синтезу гідроген хлориду було взято хлор об'ємом 5 л і водень об'ємом 8 л. Визначте об'ємний склад газової суміші, яка утвориться після реакції (об'єми газуватих реагентів і продуктів виміряно за однакових умов).
Цю задачу розв'яжімо усно, використовуючи наведене у параграфі хімічне рівняння синтезу гідроген хлориду. З нього очевидно, що з хлором об'ємом 5 л прореагує водень такого самого об'єму. Отже, водень об'ємом 3 л не братиме участі у реакції. Об'єм утвореного гідроген хлориду вдвічі більшим за об'єм хлору і становитиме 10 л. Тобто газова суміш після закінчення реакції міститиме гідроген хлорид об'ємом 10 л і водень об'ємом 3 л.
Уміння використовувати відношення об'ємів газів для обчислень за хімічними рівняннями знадобиться вам під час подальшого вивчення органічних і неорганічних речовин. У промисловості ці вміння необхідні для розрахунків об'ємів газуватих реагентів і продуктів реакцій.<u</u>
Стисло про головне
Відношення об'ємів газів у хімічних реакціях вивчало чимало науковців. Адже вимірювати об'єми газів набагато простіше, ніж їхні маси. Здобуті разом з О. Гумбольдтом експериментальні дані Ж.Л. Гей-Люссак узагальнив у законі об'ємних відношень: за однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою як невеликі цілі числа.
Дослідження Гей-Люссака та відкриті ним закономірності стали вагомим внеском у розвиток уявлень про атоми й молекули.
Застосуйте свої знання й уміння
1. Виберіть правильне доповнення твердження. За однакових умов об'єми газуватих речовин у хімічних реакціях співвідносяться між собою як:
А Невеликі цілі числа; Б Цілі числа, кратні десяти; В Дробові числа, кратні числу Авогадро; Г Індекси у хімічних формулах.
2. Виберіть об'єм (л) водню, який витратився у реакції з киснем, якщо продукт взаємодії - водяна пара об'ємом 300 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):
А 150; Б 300; В 450; Г 600.
3. Виберіть об'єм (л) хлору, витраченого на повне хлорування метану, якщо один з продуктів реакції - гідроген хлорид об'ємом 40 л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):
А 20; Б 40; В 80; Г 160.
4. Виберіть об'єм (л) метану, на повне хлорування якого було витрачено хлор об'ємом 16л (об'єми газуватих реагентів і продуктів виміряно за однакових умов):
А4; Б8; В 16; Г32.
5. Для синтезу гідроген хлориду було взято хлор об'ємом 0,4 л і водень об'ємом 0,2 л. Визначте об'ємний склад газової суміші, яка утвориться після реакції (об'єми газуватих реагентів і продуктів виміряно за однакових умов).
6. Виберіть об'єм (л) гідроген хлориду, який утворився на першій стадії хлорування метану об'ємом 6 л (об'єми газуватих реагентів і продуктів виміряне за однакових умов):
А 6; Б 12; В 18; Г 24.
7. У побутовому газовому котлі з бойлером витрати метану становлять 4,38 м3/год. Обчисліть об'єм вуглекислого газу, який утвориться внаслідок безперервної роботи котла упродовж доби (об'єми газуватих реагентів і продуктів виміряно за однакових умов).
8. У газовому котлі витрати метану становлять 0,9 м3/год. Обчисліть об'єм кисню, який витрачається внаслідок безперервної роботи котла упродовж 5 годин (об'єми газуватих реагентів і продуктів виміряно за однакових умов).
9. *Позашляховик, який працює на водневому паливі, витрачає водень масок: 4,2 кг на 320 км пробігу. Водень міститься у вуглепластиковому балоні під тиском до 700 атм. За нормальних умов об'єм цієї порції водню становив би 47,04 м3. Обчисліть об'єм кисню (н. у.), який витрачається на подолань цим автомобілем шляху завдовжки 960 км (об'єми газуватих реагентів продуктів виміряно за однакових умов).
Скарбничка досвіду
Роздивіться марку, зображену на малюнку 21.8.

Дізнайтеся, якій події вона присвячена Портрет якого науковця, що теж брав участь у цьому дослідженні, не потрапив на марку? Для чого дослідники взяли із собою термометр, барометр та скляні бутлі з добре притертими пробками? Яких висновків дійшли вчені на основі здобутих результатів? Підготуйте повідомлення про життя й наукові здобутки вченого, зображеного на марці.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|


















