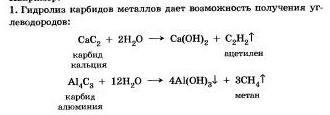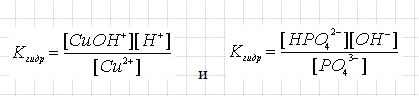|
|
|
| Строка 180: |
Строка 180: |
| | Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой.<br> | | Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой.<br> |
| | | | |
| - | <h2>Какие факторы способны влиять на степень гидролиза</h2> | + | <h2>Какие факторы способны воздействовать на степень гидролиза</h2> |
| | | | |
| - | Как вам уже известно, из определения – гидролиз является процессом разложения с помощью воды. В растворе соли находятся в виде ионов и их движущей силой, которая провоцирует такую реакцию, является образование малодиссоциирующих частиц. Такое явление свойственно многим реакциям, происходящим в растворах. | + | Как вам уже известно, из определения – гидролиз является процессом разложения с помощью воды. В растворе соли присутствуют в виде ионов и их движущей силой, которая провоцирует такую реакцию, называют образование малодиссоциирующих частиц. Такое явление свойственно многим реакциям, происходящим в растворах. |
| | | | |
| - | Но не всегда ионы при взаимодействии с водой образуют малодиссоциирующие частицы. Так, как вам уже известно, что соль состоит из катиона и аниона, то при этом возможны такие типы гидролиза, как: | + | Но не всегда ионы, взаимодействуя с водой, создают малодиссоциирующие частицы. Так, как вам уже известно, что соль складывается из катиона и аниона, то при этом возможны такие типы гидролиза, как: |
| | | | |
| | • В случае вступления реакции воды с катионом, мы получаем гидролиз по катиону;<br> | | • В случае вступления реакции воды с катионом, мы получаем гидролиз по катиону;<br> |
| Строка 190: |
Строка 190: |
| | • При одновременном вступлении катиона и аниона в реакцию с водой мы получаем совместный гидролиз.<br> | | • При одновременном вступлении катиона и аниона в реакцию с водой мы получаем совместный гидролиз.<br> |
| | | | |
| - | Поскольку мы с вами уже знаем, что гидролиз имеет обратимую реакцию, то на состояние его равновесия влияют некоторые факторы, к которым относится: температура, концентрация продуктов гидролиза, концентрации участников реакции, добавки посторонних веществ. Но в том случае, если газообразные вещества не принимают участия в реакции, то на давление эти вещества не влияют, за исключением воды, так как ее концентрация является постоянной.
| + | Потому как нам уже известно, что гидролиз имеет обратимую реакцию, то на состояние его равновесия влияют некоторые факторы, к которым относится: температура, концентрация продуктов гидролиза, концентрации участников реакции, добавки посторонних веществ. Но, когда газообразные вещества не берут участия в реакции, то на давление эти вещества не влияют, за исключением воды, поскольку ее концентрация является постоянной. |
| | | | |
| | Теперь рассмотрим примеры выражений констант гидролиза: | | Теперь рассмотрим примеры выражений констант гидролиза: |
| Строка 198: |
Строка 198: |
| | <br> | | <br> |
| | | | |
| - | К фактору, влияющему на состояние равновесия гидролиза, относится температура. В этом случае при повышении температуры происходит смещение равновесия системы вправо и в этом случае степень гидролиза возрастает.
| + | Фактором, который воздействует на состояние равновесия гидролиза, может стать температура. Так при повышении температуры происходит смещение равновесия системы вправо и в таком случае степень гидролиза возрастает. |
| | | | |
| - | Если следовать принципам Ле Шателье, то мы видим, что при повышении концентрации ионов водорода, происходит смещение равновесия влево, при этом уменьшиться степень гидролиза, а при увеличении концентрации влияние для реакции мы видим на второй формуле. | + | Если следовать принципам Ле Шателье, то мы видим, что при росте концентрации ионов водорода, происходит сдвиг равновесия влево, при этом уменьшиться степень гидролиза, а при повышении концентрации влияние для реакции мы видим на второй формуле. |
| | | | |
| - | При концентрации солей мы можем наблюдать, что равновесие в системе смещается вправо, но при этом степень гидролиза, если следовать принципам Ле Шателье - уменьшается. Если мы этот процесс рассмотрим с точки зрения константы, то увидим, что про добавлении фосфат-ионов, равновесие сместиться вправо и их концентрация будет возрастать. То есть, чтобы увеличить увеличить концентрацию гидроксид-ионов вдвое, необходимо концентрацию фосфат-ионов увеличить в четыре раза, хотя значение константы меняться не должно. Из этого следует вывод, что отношение <br> | + | При концентрации солей мы можем наблюдать, что равновесие в системе смещается вправо, однако при этом степень гидролиза, если следовать принципам Ле Шателье - уменьшается. Если мы этот процесс рассмотрим с точки зрения константы, то увидим, что про добавлении фосфат-ионов, равновесие сместиться вправо и их концентрация будет возрастать. То есть, для повышения концентрации гидроксид-ионов вдвое, необходимо концентрацию фосфат-ионов повысить в четыре раза, хотя значение константы меняться не должно. Из этого следует вывод, что отношение <br> |
| | [[Image:11kl_Gidrol02.jpg|100x100px|гидролиз]] | | [[Image:11kl_Gidrol02.jpg|100x100px|гидролиз]] |
| - | уменьшится в два раза. | + | уменьшится в 2 раза. |
| | | | |
| - | При факторе разбавления происходит одновременное уменьшение частиц, находящихся в растворе, кроме воды. Если следовать принципу Ле Шателье, то мы видим, что происходит смещение равновесия и увеличивается число частиц. Но такая реакция гидролиза происходит, не учитывая воду. При этом разбавление равновесия сдвигается в сторону протекания этой реакции, то есть вправо и естественно, что степень гидролиза возрастет. | + | При факторе разбавления происходит одновременное уменьшение частиц, что находятся в растворе, кроме воды. Если следовать принципу Ле Шателье, то мы видим, что происходит смещение равновесия и увеличивается число частиц. Но такая реакция гидролиза происходит, не учитывая воду. При этом разбавление равновесия сдвигается в сторону протекания данной реакции, то есть вправо и естественно, что степень гидролиза возрастет. |
| | | | |
| - | На положение равновесия могут влиять добавки посторонних веществ, в случае если они дают реакцию с одним из участников реакции. Так, например, если к раствору сульфата меди мы добавим раствор гидроксида натрия, то в этом случае находящиеся в нем гидроксид-ионы вступят во взаимодействие с ионами водорода. В этом случае из принципа Ле Шателье следует, что в итоге концентрация уменьшиться, равновесие сместиться вправо, а степень гидролиза возрастет. Ну, а в случае добавления к раствору сульфида натрия, то равновесие сместится влево, из-за связывания ионов меди в практически нерастворимый сульфид меди. | + | На положение равновесия могут влиять добавки посторонних веществ, при условии что они дают реакцию с одним из участников реакции. К примеру, если к раствору сульфата меди мы добавим раствор гидроксида натрия, то в этом случае присутствующие в нем гидроксид-ионы начнут взаимодействовать с ионами водорода. В этом случае из принципа Ле Шателье следует, что в итоге концентрация уменьшиться, равновесие сместиться вправо, а степень гидролиза возрастет. Ну, а когда к раствору добавить сульфид натрия, то равновесие сместится влево, из-за связывания ионов меди в практически нерастворимый сульфид меди. |
| | | | |
| | Подведем итог из изученного материала и придем к выводу, что тема гидролиза не является сложной, но необходимо четко усвоить, что такое гидролиз, иметь общие представления о смещении химического равновесия и запомнить алгоритм написания уравнений. | | Подведем итог из изученного материала и придем к выводу, что тема гидролиза не является сложной, но необходимо четко усвоить, что такое гидролиз, иметь общие представления о смещении химического равновесия и запомнить алгоритм написания уравнений. |
Текущая версия на 12:26, 9 июня 2015
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Гидролиз
Определение гидролиза
Вы знаєте, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греческого hydro — вода, lysis — разложение, расиад).
Гидролиз — это реакция обменного разложения веществ водой.
Гидролизу подвергаются различные вещества: неорганические - соли, карбиды и гидриды металлов, галогениды неметаллов; органические — гялогеналканы. сложные зфиры и жиры, углеводы, белки, полинуклеотиды.
Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение.
Гидролиз органических веществ
Гидролиз галогеналканов
Гидролиз галогеналканов используют дли получения спиртов.
Присутствие щелочи (ОН ) иоэволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования спирта.
Гидролиз сложных эфиров
Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты.
Для смещения химическое равновесии в сторону продуктов реакции гидролиз проводят в присутствии щелочи.
Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль. нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными., производными трехатомного спирта глицерина — триглицеридамн. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют «омылением».
Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами:
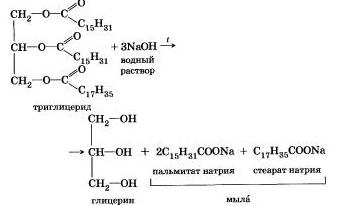
Натриевые соли высших карбоновых кислот — основные компоненты твердого мыла, калиевые соли — жидкого мыла.
Французский химик М. Бертло в 1854 г. осуществил реакцию этерификации и впервые синтезировал жир. Следовательно, гидролиз жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так:
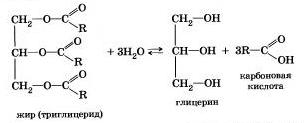
В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидратизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролиэу-ются и затем постепенно окисляются до оксида углерода и воды с выделеиием энергии, необходимой для жизнедеятельности.
В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла.
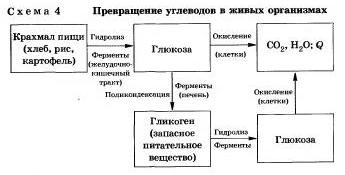
Гидролиз углеводов
Как вы зияете, углеводы являются важнейшими компонентами нашей пищи. Причем ди- (сахароза, лактоза, мальтоза) и полисахариды {крахмал, гликогеи) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу. Гидролиз крахмала идет ступенчато.
В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании.
Реакцию гидролиза крахмала до глюкозы при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф.
В организме человека и животных гидролиз углеводов происходит под действием ферментов (схема 4).
Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле.
Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе п жареном картофеле, а также образование плотной пленки на накрал малеином белье под действием горячего утюга.
Еще один известный вам полисахарид — целлюлоза — также может гидролизоваться до глюкозы при длительном нагревании с минеральными кислотами. Процесс идет стуненчато, но кратко. Этот процесс лежит в основе многих гидролизных производств. Они служат для получения пищевых, кормовых и технических продуктов из непищевого растительиого сырья — отходов лесозаготовок, деревообработки (опилки, стружка, щепа), переработки сельскохозяйственных культур (соломы, шелухи семян, кочерыжек кукурузы и т. д.).
Техническими продуктами таких производств являются глицерин, этиленгликоль. органические кислоты, кормовые дрожжи, этиловый снирт, сорбит (шестиатомвый спирт).
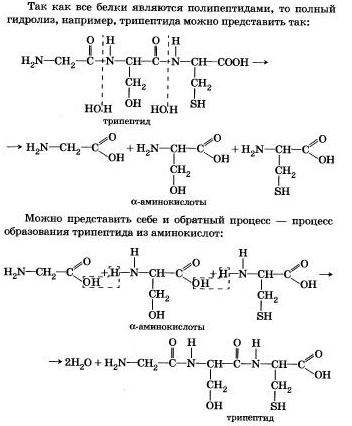
Гидролиз белка
Вы знаете, что белки-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из аминокислот (наиболее часто встречаются 20). Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов.
Гидролиз аденозинтрифосфорной кислоты
Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (ЛТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе ЛТФ до аденозиндифосфорной кислоты (АДФ) энергия высвобождается.
Обратный процесс образование ЛТФ из АДФ протекпет с поглощением энергии. Следовательно. АТФ это универсальное энергетическое вещество клетки.
Водные растворы солей имеют разные значения ph и различные типы сред — кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН - 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Гидролиз солей
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссо-циирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н- или ОН+ и распор соли становится кислотным или щелочным соответственно.
Любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей (схема 6).
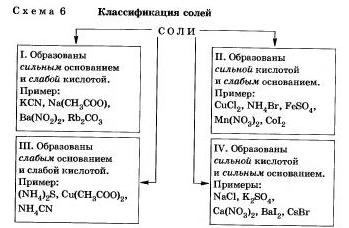
Рассмотрим поведение солей различных типов в растворе
Соли, образованные сильным основанием и слабой кислотой
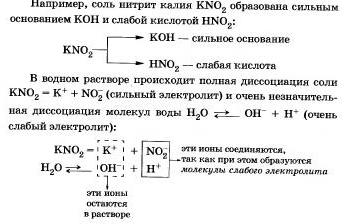
Этот процесс обратим, химическое равновесие смещено влево (в сторону образования исходных веществ), так как вода - значительно более слабый электролит, чем азотистая кислота.
Сокращенное ионное уравнение гидролиза покалывает, что:
а) в растворе есть свободные гидроксидионы ОН и концентрация их больше, чем в чистой воде, поэтому раствор соли KN02 имеет щелочную среду (рН > 7);
б) в реакции с водой участвуют анионы N02-; в таком случае говорят, что идет гидролиз по аниону.
Другие примеры анионов, которые участвуют в реакции с водой:
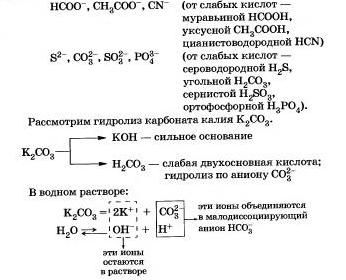
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) во аниону соли, кпк правило, гидролиэуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солеи щелочная (рН > 7);
г) при гидролизе солей, образованных слабыми многоос-новными кислотами, получаются кислые соли.
Соли, образованные сильной кислотой и слабым основанием.
Например, рассмотрим гидролиз иодида аммония NН4I.
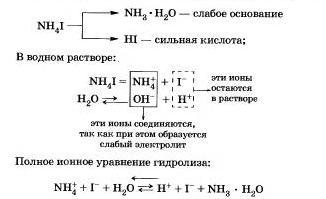
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, так как вода Н20 значительно более слабый электролит, чем гидрат аммиака.
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода Н и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (рН < 7);
б) в реакции с водой участвуют катионы аммония; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные М2+ , кроме катионов щелочноземельных металлов, трехраэрядные
М3+ .
Рассмотрим гидролиз хлорида никеля NiСl2.
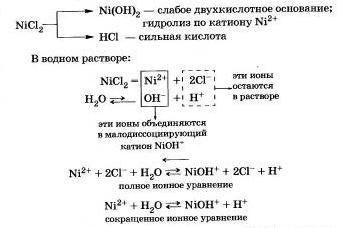
Продукты гидролиза — основная соль Ni0НСl и соляная кислота НСl.
Среда водного раствора хлорида никеля кислотная (рН < 7), потому что в растворе увеличивается концентрация ионов Н+.
Гидролиз соли Ni0НСl протекает в значительно меньшей степени, и им можно пренебречь.
Подведем ктог тому, что вы узнали о гидролизе по катиону: а) по катиону соли, как праймдо. гилродизутотся обратимо
б) химическое равновесие реакций силывосвииванво влево
III. Соли, образованные слабым основанием и слабой кислотой.
Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу по катиону,и по аниону.
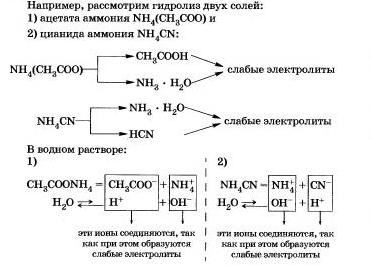
Как вы уже заметили, гидролиз большинства солей является обратимым процессом. Однако некоторые соли полностью разлагаются водой, т. е. их гидролиз является необратимым процессом.
Выводы:
а) если соли гидролизируются и по катиону, и но аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;
б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;
в) соли могут гидролизироваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
Соли, образованные сильным основанием и сильной кислотой
Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами.
Рассмотрим «поведение» в растворе хлорида калия КСl.
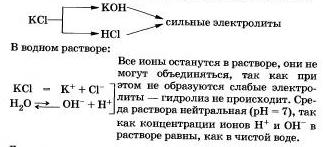
Другими примерами подобных солей могут быть нитраты, перхлораты, сульфаты, хромиты и дихроматы щелочных металлов, галогиды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Обобщим информацию о гидролизе солей в таблице 14. Следует также отметить, что реакции обратимого гидролиза полностью подчиняются принципу Ле Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
а) добавить воды (уменьшить концентрацию);
б) нагреть раствор, при этом усиливается эндотермическая диссоциация воды, а значит, увеличивается количество ионов Н и ОН , которые необходимы для осуществления гидролиза соли;

в) связать один из продуктов гидролиза в трудиорвстворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианид аммония будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака, и воды.
Гидролиз можно подавить (значительно уменьшить коли чество подвергающейся гидролизу соли).
а) увеличить концентрацию растворенного вещества
б) охладить раствор;
а) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его г|я*дя в результате гидролиза кислотная, или подщелачивать, если — щелочная.
Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение.
Еще в древности в качестве моющего средства использовали молу. В золе содержится карбонат калия, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рh среды.
Соли, создающие необходимую щелочную срелу раствора, содержатся в фотографическом проявителе. Это карбонат натрия, карбонат калия, бура и другие соли, гидролизующиеся но аниону.
Если кислотность почвы недостаточная, у растений появляется болезнь — хлороз. Ее признаки - пожелтение или побеление листьев, отставание в росте и развитии. Если рН> 7,5, то в нее вносят удобрение сульфат аммония, которое способствует повышению кислотности, благодаря гидролизу по катиону, проходящему в почве.
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав организма.
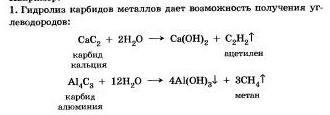
Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой.
Какие факторы способны воздействовать на степень гидролиза
Как вам уже известно, из определения – гидролиз является процессом разложения с помощью воды. В растворе соли присутствуют в виде ионов и их движущей силой, которая провоцирует такую реакцию, называют образование малодиссоциирующих частиц. Такое явление свойственно многим реакциям, происходящим в растворах.
Но не всегда ионы, взаимодействуя с водой, создают малодиссоциирующие частицы. Так, как вам уже известно, что соль складывается из катиона и аниона, то при этом возможны такие типы гидролиза, как:
• В случае вступления реакции воды с катионом, мы получаем гидролиз по катиону;
• Если же происходит реакция воды только с анионом, то получаем гидролиз по аниону;
• При одновременном вступлении катиона и аниона в реакцию с водой мы получаем совместный гидролиз.
Потому как нам уже известно, что гидролиз имеет обратимую реакцию, то на состояние его равновесия влияют некоторые факторы, к которым относится: температура, концентрация продуктов гидролиза, концентрации участников реакции, добавки посторонних веществ. Но, когда газообразные вещества не берут участия в реакции, то на давление эти вещества не влияют, за исключением воды, поскольку ее концентрация является постоянной.
Теперь рассмотрим примеры выражений констант гидролиза:
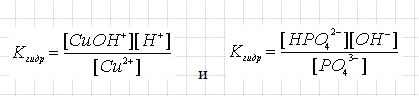
Фактором, который воздействует на состояние равновесия гидролиза, может стать температура. Так при повышении температуры происходит смещение равновесия системы вправо и в таком случае степень гидролиза возрастает.
Если следовать принципам Ле Шателье, то мы видим, что при росте концентрации ионов водорода, происходит сдвиг равновесия влево, при этом уменьшиться степень гидролиза, а при повышении концентрации влияние для реакции мы видим на второй формуле.
При концентрации солей мы можем наблюдать, что равновесие в системе смещается вправо, однако при этом степень гидролиза, если следовать принципам Ле Шателье - уменьшается. Если мы этот процесс рассмотрим с точки зрения константы, то увидим, что про добавлении фосфат-ионов, равновесие сместиться вправо и их концентрация будет возрастать. То есть, для повышения концентрации гидроксид-ионов вдвое, необходимо концентрацию фосфат-ионов повысить в четыре раза, хотя значение константы меняться не должно. Из этого следует вывод, что отношение
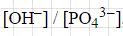 уменьшится в 2 раза.
уменьшится в 2 раза.
При факторе разбавления происходит одновременное уменьшение частиц, что находятся в растворе, кроме воды. Если следовать принципу Ле Шателье, то мы видим, что происходит смещение равновесия и увеличивается число частиц. Но такая реакция гидролиза происходит, не учитывая воду. При этом разбавление равновесия сдвигается в сторону протекания данной реакции, то есть вправо и естественно, что степень гидролиза возрастет.
На положение равновесия могут влиять добавки посторонних веществ, при условии что они дают реакцию с одним из участников реакции. К примеру, если к раствору сульфата меди мы добавим раствор гидроксида натрия, то в этом случае присутствующие в нем гидроксид-ионы начнут взаимодействовать с ионами водорода. В этом случае из принципа Ле Шателье следует, что в итоге концентрация уменьшиться, равновесие сместиться вправо, а степень гидролиза возрастет. Ну, а когда к раствору добавить сульфид натрия, то равновесие сместится влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
Подведем итог из изученного материала и придем к выводу, что тема гидролиза не является сложной, но необходимо четко усвоить, что такое гидролиз, иметь общие представления о смещении химического равновесия и запомнить алгоритм написания уравнений.
Задания
1. Выберите примеры органических веществ, подвергающихся гидролизу:
глюкоза, этанол, бромметан, метаналь, сахароза, метиловый эфир муравьиной кислоты, стеариновая кислота, 2-метил бутан.
Составьте уравнения реакций гидролиза; в случае обратимого гидролиза укажите условия, позволяющие сместить химическое равновесие в сторону образования продукта реакции.
2. Кикие соли подвергаются гидролизу? Какую среду могут иметь при этом водные растворы солей? Приведите примеры.
3. Какие из солей подвергаются гидролизу по катиону? Составьте уравнения их гидролиза, укажите среду.
4. Какие из солей подвергаются гидролизу по аниону?
5*. Добавление каких из приведенных ниже веществ к раствору хлорида желеэа(ІІІ) усилит гидролиз соли: HCI, NaOH, ZnCl2? Дайте пояснения.
6. Подложите способы подавления гидролиза водного раствора сульфида калия.
задачи по химии 11 класс, ответы на тесты по химии, таблицы к урокам 11 класса
|