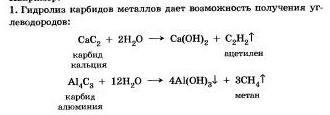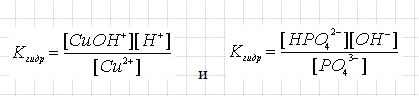Версия 11:42, 9 июня 2015Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Гидролиз
Определение гидролизаВы знаєте, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греческого hydro — вода, lysis — разложение, расиад).
Гидролизу подвергаются различные вещества: неорганические - соли, карбиды и гидриды металлов, галогениды неметаллов; органические — гялогеналканы. сложные зфиры и жиры, углеводы, белки, полинуклеотиды.
Гидролиз органических веществ
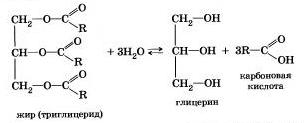
Гидролиз галогеналкановГидролиз галогеналканов используют дли получения спиртов. Гидролиз сложных эфировГидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты.
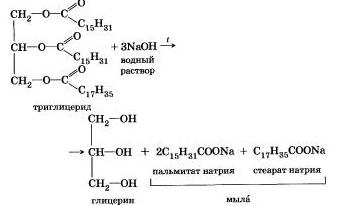
Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами:
Натриевые соли высших карбоновых кислот — основные компоненты твердого мыла, калиевые соли — жидкого мыла.
В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидратизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролиэу-ются и затем постепенно окисляются до оксида углерода и воды с выделеиием энергии, необходимой для жизнедеятельности.
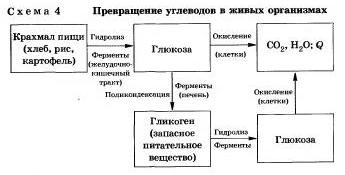
Гидролиз углеводовКак вы зияете, углеводы являются важнейшими компонентами нашей пищи. Причем ди- (сахароза, лактоза, мальтоза) и полисахариды {крахмал, гликогеи) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу. Гидролиз крахмала идет ступенчато.
Еще один известный вам полисахарид — целлюлоза — также может гидролизоваться до глюкозы при длительном нагревании с минеральными кислотами. Процесс идет стуненчато, но кратко. Этот процесс лежит в основе многих гидролизных производств. Они служат для получения пищевых, кормовых и технических продуктов из непищевого растительиого сырья — отходов лесозаготовок, деревообработки (опилки, стружка, щепа), переработки сельскохозяйственных культур (соломы, шелухи семян, кочерыжек кукурузы и т. д.).
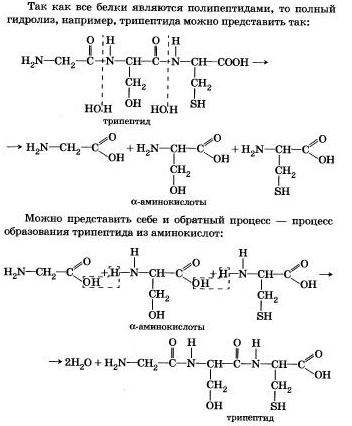
Гидролиз белкаВы знаете, что белки-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из аминокислот (наиболее часто встречаются 20). Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов.
Гидролиз аденозинтрифосфорной кислотыНеизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (ЛТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе ЛТФ до аденозиндифосфорной кислоты (АДФ) энергия высвобождается. Гидролиз солей
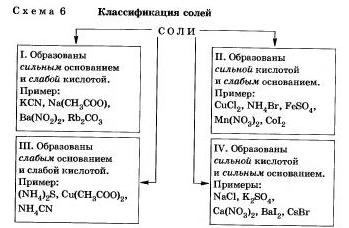
В зависимости от силы основания и кислоты можно выделить 4 типа солей (схема 6).
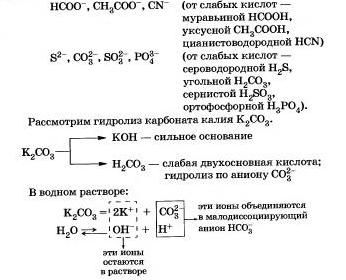
Рассмотрим поведение солей различных типов в растворе Соли, образованные сильным основанием и слабой кислотой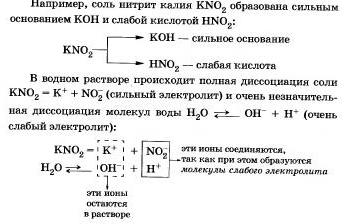
Этот процесс обратим, химическое равновесие смещено влево (в сторону образования исходных веществ), так как вода - значительно более слабый электролит, чем азотистая кислота.
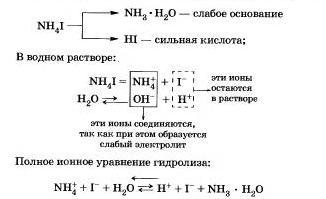
Подведем итог тому, что вы узнали о гидролизе по аниону: Соли, образованные сильной кислотой и слабым основанием.
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, так как вода Н20 значительно более слабый электролит, чем гидрат аммиака.
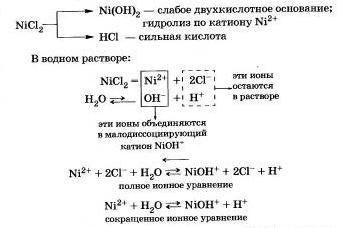
Продукты гидролиза — основная соль Ni0НСl и соляная кислота НСl.
Гидролиз соли Ni0НСl протекает в значительно меньшей степени, и им можно пренебречь.
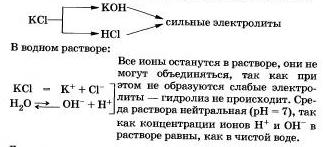
Как вы уже заметили, гидролиз большинства солей является обратимым процессом. Однако некоторые соли полностью разлагаются водой, т. е. их гидролиз является необратимым процессом. Выводы: Соли, образованные сильным основанием и сильной кислотойСоли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами.
Другими примерами подобных солей могут быть нитраты, перхлораты, сульфаты, хромиты и дихроматы щелочных металлов, галогиды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
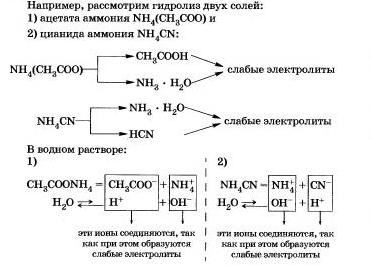
в) связать один из продуктов гидролиза в трудиорвстворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианид аммония будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака, и воды.
а) увеличить концентрацию растворенного вещества Значение гидролизаГидролиз солей имеет и практическое, и биологическое значение. Еще в древности в качестве моющего средства использовали молу. В золе содержится карбонат калия, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН. В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются. В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рh среды. Соли, создающие необходимую щелочную срелу раствора, содержатся в фотографическом проявителе. Это карбонат натрия, карбонат калия, бура и другие соли, гидролизующиеся но аниону.
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав организма. Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой. Какие факторы способны влиять на степень гидролизаКак вам уже известно, из определения – гидролиз является процессом разложения с помощью воды. В растворе соли находятся в виде ионов и их движущей силой, которая провоцирует такую реакцию, является образование малодиссоциирующих частиц. Такое явление свойственно многим реакциям, происходящим в растворах. Но не всегда ионы при взаимодействии с водой образуют малодиссоциирующие частицы. Так, как вам уже известно, что соль состоит из катиона и аниона, то при этом возможны такие типы гидролиза, как: • В случае вступления реакции воды с катионом, мы получаем гидролиз по катиону; Поскольку мы с вами уже знаем, что гидролиз имеет обратимую реакцию, то на состояние его равновесия влияют некоторые факторы, к которым относится: температура, концентрация продуктов гидролиза, концентрации участников реакции, добавки посторонних веществ. Но в том случае, если газообразные вещества не принимают участия в реакции, то на давление эти вещества не влияют, за исключением воды, так как ее концентрация является постоянной. Теперь рассмотрим примеры выражений констант гидролиза: К фактору, влияющему на состояние равновесия гидролиза, относится температура. В этом случае при повышении температуры происходит смещение равновесия системы вправо и в этом случае степень гидролиза возрастает. Если следовать принципам Ле Шателье, то мы видим, что при повышении концентрации ионов водорода, происходит смещение равновесия влево, при этом уменьшиться степень гидролиза, а при увеличении концентрации влияние для реакции мы видим на второй формуле. При концентрации солей мы можем наблюдать, что равновесие в системе смещается вправо, но при этом степень гидролиза, если следовать принципам Ле Шателье - уменьшается. Если мы этот процесс рассмотрим с точки зрения константы, то увидим, что про добавлении фосфат-ионов, равновесие сместиться вправо и их концентрация будет возрастать. То есть, чтобы увеличить увеличить концентрацию гидроксид-ионов вдвое, необходимо концентрацию фосфат-ионов увеличить в четыре раза, хотя значение константы меняться не должно. Из этого следует вывод, что отношение При факторе разбавления происходит одновременное уменьшение частиц, находящихся в растворе, кроме воды. Если следовать принципу Ле Шателье, то мы видим, что происходит смещение равновесия и увеличивается число частиц. Но такая реакция гидролиза происходит, не учитывая воду. При этом разбавление равновесия сдвигается в сторону протекания этой реакции, то есть вправо и естественно, что степень гидролиза возрастет. На положение равновесия могут влиять добавки посторонних веществ, в случае если они дают реакцию с одним из участников реакции. Так, например, если к раствору сульфата меди мы добавим раствор гидроксида натрия, то в этом случае находящиеся в нем гидроксид-ионы вступят во взаимодействие с ионами водорода. В этом случае из принципа Ле Шателье следует, что в итоге концентрация уменьшиться, равновесие сместиться вправо, а степень гидролиза возрастет. Ну, а в случае добавления к раствору сульфида натрия, то равновесие сместится влево, из-за связывания ионов меди в практически нерастворимый сульфид меди. Подведем итог из изученного материала и придем к выводу, что тема гидролиза не является сложной, но необходимо четко усвоить, что такое гидролиз, иметь общие представления о смещении химического равновесия и запомнить алгоритм написания уравнений. Задания1. Выберите примеры органических веществ, подвергающихся гидролизу: Составьте уравнения реакций гидролиза; в случае обратимого гидролиза укажите условия, позволяющие сместить химическое равновесие в сторону образования продукта реакции. 2. Кикие соли подвергаются гидролизу? Какую среду могут иметь при этом водные растворы солей? Приведите примеры. 3. Какие из солей подвергаются гидролизу по катиону? Составьте уравнения их гидролиза, укажите среду. 4. Какие из солей подвергаются гидролизу по аниону? 5*. Добавление каких из приведенных ниже веществ к раствору хлорида желеэа(ІІІ) усилит гидролиз соли: HCI, NaOH, ZnCl2? Дайте пояснения. 6. Подложите способы подавления гидролиза водного раствора сульфида калия.
задачи по химии 11 класс, ответы на тесты по химии, таблицы к урокам 11 класса |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: