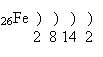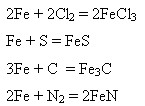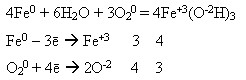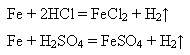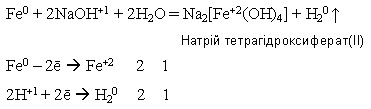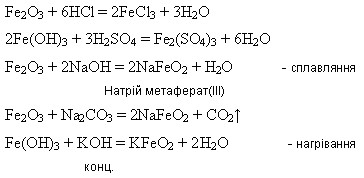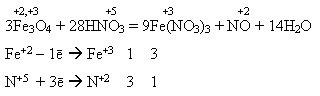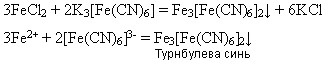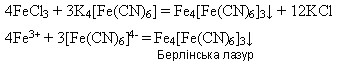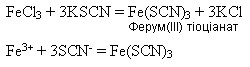|
|
|
| Строка 65: |
Строка 65: |
| | '''''Фізичні властивості заліза:''''' | | '''''Фізичні властивості заліза:''''' |
| | | | |
| - | Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см<sup>3</sup> температура плавлення t<sub>пл</sub>=1535<sup>o</sup>С. | + | Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см<sup>3</sup> температура плавлення t<sub>пл</sub>=1535<sup>o</sup>С. |
| | | | |
| | Має здатність намагнічуватися. | | Має здатність намагнічуватися. |
| Строка 153: |
Строка 153: |
| | <br><u>'''V. Домашнє завдання:'''</u> | | <br><u>'''V. Домашнє завдання:'''</u> |
| | | | |
| - | Чит. §31-32 .<br><br><br> | + | Чит. §31-32 .<br><br> |
| | | | |
| - | <br>
| + | Надіслано Шевченко В.В, вчителем хімії та біології |
| - | | + | |
| - | <br>
| + | |
| - | | + | |
| - | Виконала: студентка 51 групи хіміко-біологічного факультету Шевченко В.В.
| + | |
| | | | |
| | <br> <sub>Планування уроків з хімії [[Гіпермаркет Знань - перший в світі!|онлайн]], завдання та відповіді по класам, домашнє завдання з хімії 10 класу [[Хімія|скачати]]</sub> | | <br> <sub>Планування уроків з хімії [[Гіпермаркет Знань - перший в світі!|онлайн]], завдання та відповіді по класам, домашнє завдання з хімії 10 класу [[Хімія|скачати]]</sub> |
| | | | |
| | [[Category:Ферум_як_представник_металічних_елементів_побічних_підгруп._Конспект_уроку_і_опорний_каркас]] | | [[Category:Ферум_як_представник_металічних_елементів_побічних_підгруп._Конспект_уроку_і_опорний_каркас]] |
Текущая версия на 08:02, 17 августа 2011
Гіпермаркет Знань>>Хімія 10 клас>>Хімія>> Хімія: Ферум як представник металічних елементів побічних підгруп. Фізичні та хiмічні властивості заліза, сполуки Феруму(ІІ) і Феруму(ІІІ).
План-конспект уроку з курсу «Хімія 10 клас» з теми «Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)»
Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)
Мета:
- освітня:розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння учнів становити рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму.
- виховна: сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей заліза та його сполук, їх застосування; сприяти екологічному вихованню.
- розвиваюча:
1) розвивати спостережливість учнів на уроці хімії;
2) розвивати пізнавальний інтерес учнів до предмету;
3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей заліза та його сполук;
4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки;
5) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки. розвивати самостійність учнів під час виконання завдань.
Тип уроку: Урок засвоєння нових знань та вмінь.
Методи: загальні (ПІ), часткові (СНП), конкретні ( бесіда, розповідь).
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів.
Література:
1) Хімія. 10 клас: Розробки уроків (рівень стандарту) / А.В. Промоскаль . – Х.: Вид-во «Ранок», 2011. – 272 с.
2) А.Т. Пилипенко, В.Я. Починок, И.П. Середа, Ф.Д. Шевченко. - Справочник по элементарной химии. / Под ред. Академика АН УССР А.Т. Пилипенко. – К.: Наукова думка. – 1985.
3) Хімія. 10 клас. Стандарт і академічний рівень / І.Ю. Старовойтова,
О.В. Люсай. – Х.: Вид. група «Основа», 2010. – 79, [1]с.
4) Довідкові матеріали з хімії / І.І. Базелюк, Л.П. Величко, Н.В. Титаренко. – Київ; Ірпінь: ВТФ «Перун», 1998. – 224 с.
Хід уроку:
І. Актуалізація опорних знань:
1. Назвіть хімічні елементи головної підгрупи?
2. Назвіть хімічні властивості Алюмінію та його сполук.
3.Які ви знаєте елементи,що входять до побічних підгруп?
ІІ. Мотивація навчальної діяльності учнів:
Ми вже з вами розглянули властивості Алюмінію та його сполук, а сьогодні розглянемо властивості заліза та його сполук.
Отже, записуємо тему уроку: «Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)»
Учні повинні:
- знати: фізичні й хімічні властивості Феруму та його сполук.
- вміти: складати рівняння хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук.
ІІІ. Вивчення нового матеріалу:
Положення в Періодичній системі.Учні характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва.
Будова атома Феруму.
Учні обговорюють будову атома Феруму.
Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Будова атома: 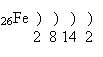
Електронна конфігурація атома Феруму: 1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
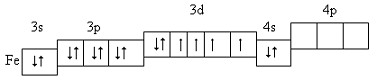
В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Найхарактерніші ступені окиснення +2 і +3
Фізичні властивості заліза:
Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см3 температура плавлення tпл=1535oС.
Має здатність намагнічуватися.
Хімічні властивості заліза та його сполук.
Взаємодія з неметалами:
1) З киснем:
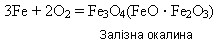
2) З іншими неметалами при підвищенні температури:
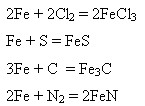
Взаємодія з водою після зняття оксидної плівки:
У розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
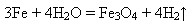
На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум(ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії:
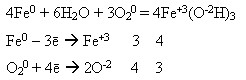
взаємодіє з хлоридною і розбавленою сульфатною кислотами:
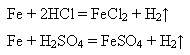
Концентрована (безводна) сульфатна кислота пасивує залізо, що дає змогу зберігати і перевозити її у залізних цистернах. Концентрована нітратна кислота також пасивує залізо.
Залізо відновлює менш активні метали з розчинів їхніх солей:
Fe + CuSO4 = FeSO4 + Cu
у подрібненому вигляді залізо може взаємодіяти з концентрованим гарячим розчином лугу з утворенням комплексних гідроксисолей:
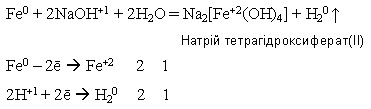
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
FeO + 2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + H2O
Ферум(ІІ) оксид з лугами не взаємодіє.
Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу:
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4]
//////////////////////////////////////////////////////// Натрій тетрагідроксиферат(ІІ)
Ферум(ІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІ):
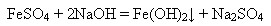
Саме так відбувається реакція без доступу повітря. У протилежному разі ферум(ІІ) гідроксид легко окиснюється до ферум(ІІІ) гідроксиду:
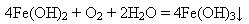
Сполуки Феруму(ІІІ).
Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
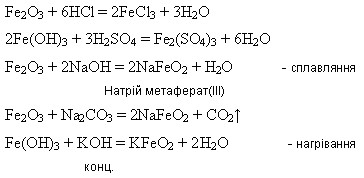
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку Fe – O із підвищенням ступеня окиснення Феруму.
Ферум(ІІІ) оксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
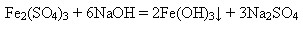
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид.
Під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Під час взаємодії з нітратною кислотою утворюється лише одна сіль – ферум(ІІІ) нітрат внаслідок окиснення сполук Феруму(ІІ) до сполук Феруму(ІІІ):
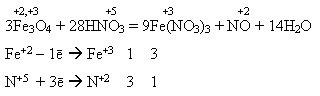
Якісні реакції на солі Феруму(ІІ) і Феруму(ІІІ)
Реактивом на йони Феруму(ІІ) є червона кров’яна сіль K3[Fe(CN)6 ] - калій гексаціаноферат(ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:
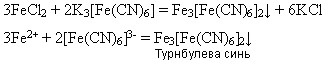
Реактивом на йони Феруму(ІІІ) є жовта кров’яна сіль K4[Fe(CN)6] - калій гексаціаноферат(ІІ), яка під час взаємодії з солями Феруму(ІІІ) дає осад синього кольору – берлінську лазур:
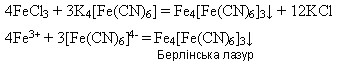
Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH4SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору:
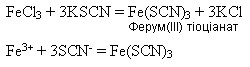
Поширення в природі:
Основні природні сполуки Феруму:
Застосування:
Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 • nH2O, сидерит FеСО3, пірит FеS2.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
ІV. Узагальнення та систематизація знань.
Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень:
1)
2)
V. Домашнє завдання:
Чит. §31-32 .
Надіслано Шевченко В.В, вчителем хімії та біології
Планування уроків з хімії онлайн, завдання та відповіді по класам, домашнє завдання з хімії 10 класу скачати
Предмети > Хімія > Хімія 10 клас > Ферум як представник металічних елементів побічних підгруп. Фізичні та хiмічні властивості заліза, сполуки Феруму(ІІ) і Феруму(ІІІ) > Ферум як представник металічних елементів побічних підгруп. Конспект уроку і опорний каркас
|