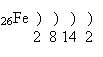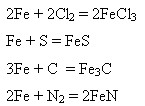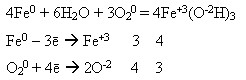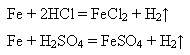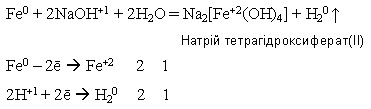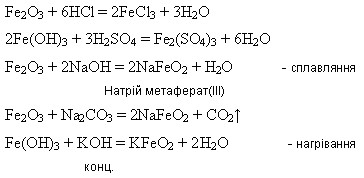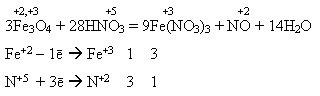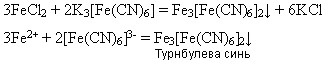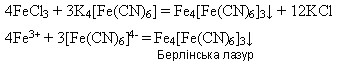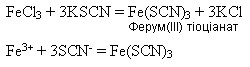|
|
|
| Строка 7: |
Строка 7: |
| | <br> | | <br> |
| | | | |
| - | ''' Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)''' | + | ''' Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)''' |
| | | | |
| - | <br>'''Мета:''' | + | <br>'''Мета:''' |
| | | | |
| | '''''- освітня:'''''розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння учнів становити рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму. | | '''''- освітня:'''''розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння учнів становити рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму. |
| | | | |
| - | '''''- виховна:''''' сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей заліза та його сполук, їх застосування; сприяти екологічному вихованню. | + | '''''- виховна:''''' сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей заліза та його сполук, їх застосування; сприяти екологічному вихованню. |
| | | | |
| - | '''''- розвиваюча:''''' | + | '''''- розвиваюча:''''' |
| | | | |
| - | 1) розвивати спостережливість учнів на уроці хімії;<br>2) розвивати пізнавальний інтерес учнів до предмету;<br>3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей заліза та його сполук;<br>4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки;<br>5) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки. розвивати самостійність учнів під час виконання завдань.<br> | + | 1) розвивати спостережливість учнів на уроці хімії;<br>2) розвивати пізнавальний інтерес учнів до предмету;<br>3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей заліза та його сполук;<br>4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки;<br>5) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки. розвивати самостійність учнів під час виконання завдань.<br> |
| | | | |
| - | '''Тип уроку:''' Урок засвоєння нових знань та вмінь. | + | '''Тип уроку:''' Урок засвоєння нових знань та вмінь. |
| | | | |
| - | '''Методи:''' загальні (ПІ), часткові (СНП), конкретні ( бесіда, розповідь). | + | '''Методи:''' загальні (ПІ), часткові (СНП), конкретні ( бесіда, розповідь). |
| | | | |
| - | '''Обладнання:''' періодична система хімічних елементів, таблиця розчинності, ряд активності металів. | + | '''Обладнання:''' періодична система хімічних елементів, таблиця розчинності, ряд активності металів. |
| | | | |
| - | <br>'''Література: ''' | + | <br>'''Література: ''' |
| | | | |
| - | <br>1) Хімія. 10 клас: Розробки уроків (рівень стандарту) / А.В. Промоскаль . – Х.: Вид-во «Ранок», 2011. – 272 с.<br>2) А.Т. Пилипенко, В.Я. Починок, И.П. Середа, Ф.Д. Шевченко. - Справочник по элементарной химии. / Под ред. Академика АН УССР А.Т. Пилипенко. – К.: Наукова думка. – 1985.<br>3) Хімія. 10 клас. Стандарт і академічний рівень / І.Ю. Старовойтова, <br> О.В. Люсай. – Х.: Вид. група «Основа», 2010. – 79, [1]с.<br>4) Довідкові матеріали з хімії / І.І. Базелюк, Л.П. Величко, Н.В. Титаренко. – Київ; Ірпінь: ВТФ «Перун», 1998. – 224 с. | + | <br>1) Хімія. 10 клас: Розробки уроків (рівень стандарту) / А.В. Промоскаль . – Х.: Вид-во «Ранок», 2011. – 272 с.<br>2) А.Т. Пилипенко, В.Я. Починок, И.П. Середа, Ф.Д. Шевченко. - Справочник по элементарной химии. / Под ред. Академика АН УССР А.Т. Пилипенко. – К.: Наукова думка. – 1985.<br>3) Хімія. 10 клас. Стандарт і академічний рівень / І.Ю. Старовойтова, <br> О.В. Люсай. – Х.: Вид. група «Основа», 2010. – 79, [1]с.<br>4) Довідкові матеріали з хімії / І.І. Базелюк, Л.П. Величко, Н.В. Титаренко. – Київ; Ірпінь: ВТФ «Перун», 1998. – 224 с. |
| | | | |
| - | <br>''' Хід уроку:''' | + | <br>''' Хід уроку:''' |
| | | | |
| - | <br><u>'''І. Актуалізація опорних знань:'''</u> | + | <br><u>'''І. Актуалізація опорних знань:'''</u> |
| | | | |
| - | 1. Назвіть хімічні елементи головної підгрупи?<br> 2. Назвіть хімічні властивості Алюмінію та його сполук.<br>3.Які ви знаєте елементи,що входять до побічних підгруп? | + | 1. Назвіть хімічні елементи головної підгрупи?<br> 2. Назвіть хімічні властивості Алюмінію та його сполук.<br>3.Які ви знаєте елементи,що входять до побічних підгруп? |
| | | | |
| - | <br><u>'''ІІ. Мотивація навчальної діяльності учнів:'''</u> | + | <br><u>'''ІІ. Мотивація навчальної діяльності учнів:'''</u> |
| | | | |
| | Ми вже з вами розглянули властивості Алюмінію та його сполук, а сьогодні розглянемо властивості заліза та його сполук.<br> Отже, записуємо тему уроку: «Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)» | | Ми вже з вами розглянули властивості Алюмінію та його сполук, а сьогодні розглянемо властивості заліза та його сполук.<br> Отже, записуємо тему уроку: «Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)» |
| | | | |
| - | '''<br>Учні повинні:'''<br>'''''- знати:''''' фізичні й хімічні властивості Феруму та його сполук. | + | '''<br>Учні повинні:'''<br>'''''- знати:''''' фізичні й хімічні властивості Феруму та його сполук. |
| | | | |
| - | '''''- вміти:''''' складати рівняння хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук. | + | '''''- вміти:''''' складати рівняння хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук. |
| | | | |
| - | <br><u>'''ІІІ. Вивчення нового матеріалу:'''</u> | + | <br><u>'''ІІІ. Вивчення нового матеріалу:'''</u> |
| | | | |
| - | '''''Положення в Періодичній системі.'''''Учні характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва. | + | '''''Положення в Періодичній системі.'''''Учні характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва. |
| | | | |
| - | '''''Будова атома Феруму.''''' | + | '''''Будова атома Феруму.''''' |
| | | | |
| | Учні обговорюють будову атома Феруму. | | Учні обговорюють будову атома Феруму. |
| Строка 53: |
Строка 53: |
| | Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи. | | Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи. |
| | | | |
| - | Будова атома: [[Image:1.08-1.jpg]] | + | Будова атома: [[Image:1.08-1.jpg]] |
| | | | |
| - | <br>Електронна конфігурація атома Феруму: '''1s<sup>2</sup>2s2<sup>2</sup>p<sup>6</sup>2s<sup>2</sup>3p<sup>6</sup>3d<sup>6</sup>4s<sup>2</sup> ''' | + | <br>Електронна конфігурація атома Феруму: '''1s<sup>2</sup>2s2<sup>2</sup>p<sup>6</sup>2s<sup>2</sup>3p<sup>6</sup>3d<sup>6</sup>4s<sup>2</sup> ''' |
| | | | |
| | Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками: | | Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками: |
| Строка 61: |
Строка 61: |
| | [[Image:1.08-2.jpg]]<br> <br>В атомі Феруму вісім валентних електонів '''(3d<sup>6</sup>4s<sup>2</sup>)''', тому він виявляє змінні ступені окиснення. | | [[Image:1.08-2.jpg]]<br> <br>В атомі Феруму вісім валентних електонів '''(3d<sup>6</sup>4s<sup>2</sup>)''', тому він виявляє змінні ступені окиснення. |
| | | | |
| - | Найхарактерніші ступені окиснення +2 і +3 | + | Найхарактерніші ступені окиснення +2 і +3 |
| | | | |
| - | '''''Фізичні властивості заліза:''''' | + | '''''Фізичні властивості заліза:''''' |
| | | | |
| - | Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза [[Image:19.11-8.jpg]] = 7,87 г/см<sup>3</sup> температура плавлення t<sub>пл</sub>=1535<sup>o</sup>С. | + | Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см<sup>3</sup> температура плавлення t<sub>пл</sub>=1535<sup>o</sup>С. |
| | | | |
| | Має здатність намагнічуватися. | | Має здатність намагнічуватися. |
| | | | |
| - | '''''<br>Хімічні властивості заліза та його сполук.''''' | + | '''''<br>Хімічні властивості заліза та його сполук.''''' |
| | | | |
| - | '''''Взаємодія з неметалами:''''' | + | '''''Взаємодія з неметалами:''''' |
| | | | |
| - | <br>1) З киснем: | + | <br>1) З киснем: |
| | | | |
| - | [[Image:1.08-3.jpg]]<br> <br>2) З іншими неметалами при підвищенні температури: | + | [[Image:1.08-3.jpg]]<br> <br>2) З іншими неметалами при підвищенні температури: |
| | | | |
| - | [[Image:1.08-4.jpg]]<br> <br><br>'''''Взаємодія з водою''''' після зняття оксидної плівки: | + | [[Image:1.08-4.jpg]]<br> <br><br>'''''Взаємодія з водою''''' після зняття оксидної плівки: |
| | | | |
| | У розжареному стані (понад 700<sup>О</sup>С) взаємодіє з водою (водяною парою): | | У розжареному стані (понад 700<sup>О</sup>С) взаємодіє з водою (водяною парою): |
| Строка 137: |
Строка 137: |
| | [[Image:17.07-17.jpg]]<br> <br>Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH<sub>4</sub>SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору: | | [[Image:17.07-17.jpg]]<br> <br>Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH<sub>4</sub>SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору: |
| | | | |
| - | [[Image:17.07-18.jpg]]<br> <br>'''Поширення в природі:''' | + | [[Image:17.07-18.jpg]]<br> <br>'''Поширення в природі:''' |
| | | | |
| - | '''''Основні природні сполуки Феруму:''''' | + | '''''Основні природні сполуки Феруму:''''' |
| | | | |
| - | ''Застосування: '' | + | ''Застосування: '' |
| | | | |
| - | Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе<sub>3</sub>О<sub>4</sub>, гематит Fe<sub>2</sub>О<sub>3</sub>, лімоніт — Fe<sub>2</sub>O<sub>3</sub> • nH<sub>2</sub>O, сидерит FеСО<sub>3</sub>, пірит FеS<sub>2</sub>. | + | Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе<sub>3</sub>О<sub>4</sub>, гематит Fe<sub>2</sub>О<sub>3</sub>, лімоніт — Fe<sub>2</sub>O<sub>3</sub> • nH<sub>2</sub>O, сидерит FеСО<sub>3</sub>, пірит FеS<sub>2</sub>. |
| | | | |
| - | Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо. | + | Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо. |
| | | | |
| - | <u>'''<br>ІV. Узагальнення та систематизація знань.'''</u> | + | <u>'''<br>ІV. Узагальнення та систематизація знань.'''</u> |
| | | | |
| - | Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень: <br>1)<br><br>2) | + | Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень: <br>1)<br><br>2) |
| | | | |
| - | <br><u>'''V. Домашнє завдання:'''</u> | + | <br><u>'''V. Домашнє завдання:'''</u> |
| | | | |
| | Чит. §31-32 .<br><br><br> | | Чит. §31-32 .<br><br><br> |
Версия 13:04, 12 августа 2011
Гіпермаркет Знань>>Хімія 10 клас>>Хімія>> Хімія: Ферум як представник металічних елементів побічних підгруп. Фізичні та хiмічні властивості заліза, сполуки Феруму(ІІ) і Феруму(ІІІ).
План-конспект уроку з курсу «Хімія 10 клас» з теми «Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)»
Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)
Мета:
- освітня:розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння учнів становити рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму.
- виховна: сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей заліза та його сполук, їх застосування; сприяти екологічному вихованню.
- розвиваюча:
1) розвивати спостережливість учнів на уроці хімії;
2) розвивати пізнавальний інтерес учнів до предмету;
3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей заліза та його сполук;
4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки;
5) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки. розвивати самостійність учнів під час виконання завдань.
Тип уроку: Урок засвоєння нових знань та вмінь.
Методи: загальні (ПІ), часткові (СНП), конкретні ( бесіда, розповідь).
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів.
Література:
1) Хімія. 10 клас: Розробки уроків (рівень стандарту) / А.В. Промоскаль . – Х.: Вид-во «Ранок», 2011. – 272 с.
2) А.Т. Пилипенко, В.Я. Починок, И.П. Середа, Ф.Д. Шевченко. - Справочник по элементарной химии. / Под ред. Академика АН УССР А.Т. Пилипенко. – К.: Наукова думка. – 1985.
3) Хімія. 10 клас. Стандарт і академічний рівень / І.Ю. Старовойтова,
О.В. Люсай. – Х.: Вид. група «Основа», 2010. – 79, [1]с.
4) Довідкові матеріали з хімії / І.І. Базелюк, Л.П. Величко, Н.В. Титаренко. – Київ; Ірпінь: ВТФ «Перун», 1998. – 224 с.
Хід уроку:
І. Актуалізація опорних знань:
1. Назвіть хімічні елементи головної підгрупи?
2. Назвіть хімічні властивості Алюмінію та його сполук.
3.Які ви знаєте елементи,що входять до побічних підгруп?
ІІ. Мотивація навчальної діяльності учнів:
Ми вже з вами розглянули властивості Алюмінію та його сполук, а сьогодні розглянемо властивості заліза та його сполук.
Отже, записуємо тему уроку: «Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)»
Учні повинні:
- знати: фізичні й хімічні властивості Феруму та його сполук.
- вміти: складати рівняння хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук.
ІІІ. Вивчення нового матеріалу:
Положення в Періодичній системі.Учні характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва.
Будова атома Феруму.
Учні обговорюють будову атома Феруму.
Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Будова атома: 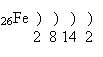
Електронна конфігурація атома Феруму: 1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
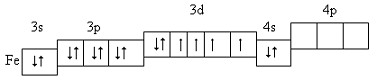
В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Найхарактерніші ступені окиснення +2 і +3
Фізичні властивості заліза:
Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см3 температура плавлення tпл=1535oС.
Має здатність намагнічуватися.
Хімічні властивості заліза та його сполук.
Взаємодія з неметалами:
1) З киснем:
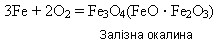
2) З іншими неметалами при підвищенні температури:
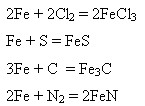
Взаємодія з водою після зняття оксидної плівки:
У розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
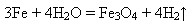
На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум(ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії:
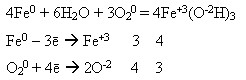
взаємодіє з хлоридною і розбавленою сульфатною кислотами:
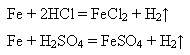
Концентрована (безводна) сульфатна кислота пасивує залізо, що дає змогу зберігати і перевозити її у залізних цистернах. Концентрована нітратна кислота також пасивує залізо.
Залізо відновлює менш активні метали з розчинів їхніх солей:
Fe + CuSO4 = FeSO4 + Cu
у подрібненому вигляді залізо може взаємодіяти з концентрованим гарячим розчином лугу з утворенням комплексних гідроксисолей:
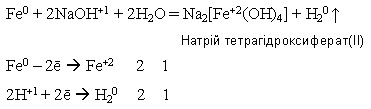
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
FeO + 2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + H2O
Ферум(ІІ) оксид з лугами не взаємодіє.
Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу:
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4]
//////////////////////////////////////////////////////// Натрій тетрагідроксиферат(ІІ)
Ферум(ІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІ):
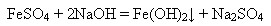
Саме так відбувається реакція без доступу повітря. У протилежному разі ферум(ІІ) гідроксид легко окиснюється до ферум(ІІІ) гідроксиду:
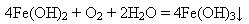
Сполуки Феруму(ІІІ).
Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
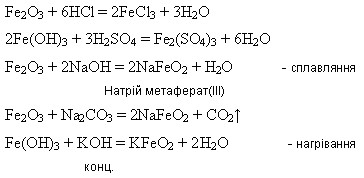
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку Fe – O із підвищенням ступеня окиснення Феруму.
Ферум(ІІІ) оксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
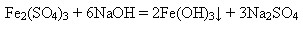
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид.
Під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Під час взаємодії з нітратною кислотою утворюється лише одна сіль – ферум(ІІІ) нітрат внаслідок окиснення сполук Феруму(ІІ) до сполук Феруму(ІІІ):
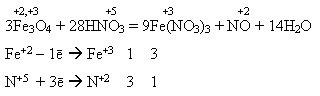
Якісні реакції на солі Феруму(ІІ) і Феруму(ІІІ)
Реактивом на йони Феруму(ІІ) є червона кров’яна сіль K3[Fe(CN)6 ] - калій гексаціаноферат(ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:
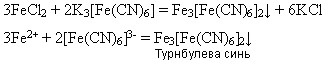
Реактивом на йони Феруму(ІІІ) є жовта кров’яна сіль K4[Fe(CN)6] - калій гексаціаноферат(ІІ), яка під час взаємодії з солями Феруму(ІІІ) дає осад синього кольору – берлінську лазур:
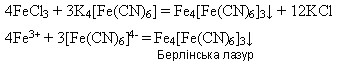
Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH4SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору:
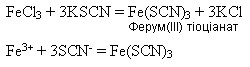
Поширення в природі:
Основні природні сполуки Феруму:
Застосування:
Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 • nH2O, сидерит FеСО3, пірит FеS2.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
ІV. Узагальнення та систематизація знань.
Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень:
1)
2)
V. Домашнє завдання:
Чит. §31-32 .
Виконала: студентка 51 групи хіміко-біологічного факультету Шевченко В.В.
Планування уроків з хімії онлайн, завдання та відповіді по класам, домашнє завдання з хімії 10 класу скачати
Предмети > Хімія > Хімія 10 клас > Ферум як представник металічних елементів побічних підгруп. Фізичні та хiмічні властивості заліза, сполуки Феруму(ІІ) і Феруму(ІІІ) > Ферум як представник металічних елементів побічних підгруп. Конспект уроку і опорний каркас
|