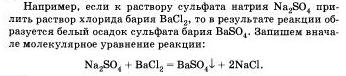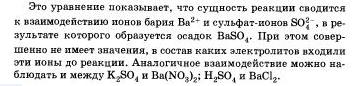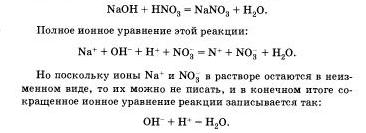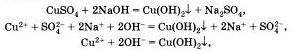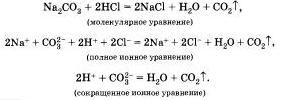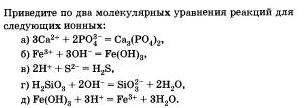|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 клас|Химия 8 класс]]>> Химия: Ионные уравнения<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Ионные уравнения, уравнения</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Ионные уравнения<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Ионные уравнения, уравнения</metakeywords>''' |
| | Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами.<br><br>Реакции между ионами называют ионными ре акциями, а уравнения таких реакций - ионными уравнениями.<br><br>При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоцвшрующих. нерастворимых и газообразных записываются в молекулярном виде. | | Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами.<br><br>Реакции между ионами называют ионными ре акциями, а уравнения таких реакций - ионными уравнениями.<br><br>При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоцвшрующих. нерастворимых и газообразных записываются в молекулярном виде. |
| | | | |
Версия 08:32, 15 июня 2010
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Ионные уравнения
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами.
Реакции между ионами называют ионными ре акциями, а уравнения таких реакций - ионными уравнениями.
При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоцвшрующих. нерастворимых и газообразных записываются в молекулярном виде.
Бели вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз, а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх.
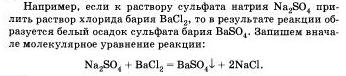
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции - в виде молекул:
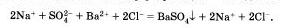
Мы записали, таким обратом, полное ионное уравнение реакции.
Если исключить из обеих частей равенства одинаковые ионы, то есть не участвующие в реакции в левой и правой часто уравнения), то получим сокращенное ионное уравнение реакции:
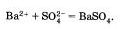
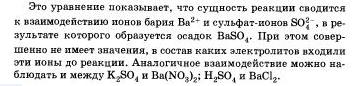
Таким образом, сокращенные ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции п показывают, какие ионы реагируют и какое вещество образуется в результате.
Реакции ионного обмена протекают до конца в тех случаях, когда образуется или осадок, или малодиссоциирующее вещество, например вода. Беля к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты, то раствор обесцветится, что послужит сигналом протекания химической реакции:
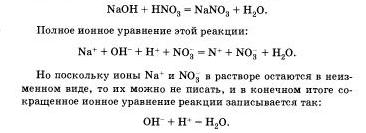
Оно показывает, что взаимодействие сильной кислоты п щелочи сводится к взаимодействию ионов Н+ и ионов ОН -, в результате которого образуется малодиссоцвирующее вещество — вода.
Указанная реакция взаимодействия сильной кислоты со щелочью называется реакцией нейтрализации. Это частный случай реакции обмена.
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди і II і со щелочью:
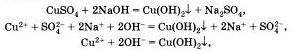
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке раствор соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трех пробирках осадок растворится. Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
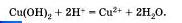
Чтобы в этом убедиться, запишите молекулярные, полные и сокращенные ионные уравнения приведенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа. В две пробирки нальем по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильем раствор соляной, а во вторую — азотной кислоты. В обоих случаях мы заметим характерное "вскипание" из-за выделяющегося углекислого газа. Запишем уравнения реакций для первого случая:
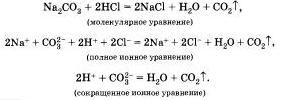
Реакции, протекающие в растворах электролитов, эапис каются с помощью ионных уравнений. Эти реакции называл реакциями ионного обмена, так как в растворах электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода.
1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому изображаются в виде ионных уравнений.
Они проще молекулярных и носят более общий характер.
2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество.
1. Молекулярное и ионное уравнения реакций.
2. Реакции нониого обмена.
3. Реакции нейтрализации.
Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой н хлоридом бария. В чем суть обеих реакций?
Запишите молекулярное п ионное уравнения реакций, о которых говорилось во второй части параграфа. — между гидроксидом меди (II) и соляной кислотой, между гид-роксидом меди (II) и азотной кислотой. В чем суть обеих реакций?
Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет ату реакцию и те реакции, о которых говорилось в конце параграфа?
Предложите свои примеры ионных реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.
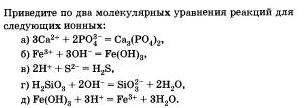
рефераты к уроку химии, цитаты для 8 класса, учебники и пособия
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|