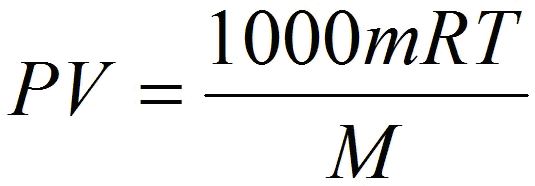|
|
|
| (1 промежуточная версия не показана) | | Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика и астрономия]]>>[[Физика 10 класс|Физика 10 класс]]>>Физика: Уравнение состояния идеального газа''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика и астрономия]]>>[[Физика 10 класс|Физика 10 класс]]>>Физика: Уравнение состояния идеального газа''' |
| - |
| |
| | <br> | | <br> |
| - |
| |
| | <metakeywords>Физика, 10 класс, Уравнение состояния, идеального газа</metakeywords> | | <metakeywords>Физика, 10 класс, Уравнение состояния, идеального газа</metakeywords> |
| - |
| |
| - | '''Уравнение состояния идеального газа'''
| |
| | | | |
| | <h2>Состояние идеального газа</h2> | | <h2>Состояние идеального газа</h2> |
| | | | |
| - | Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Но, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и поэтому имеют некую зависимость друг от друга. | + | Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Однако, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и соответственно они немного зависимы друг от друга. |
| | | | |
| - | При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. В связи с этим газовые законы, а также следствия из них, как правило, не нарушаются только для разреженных реальных газов. То есть, для газов, у которых расстояние между частицами ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально. | + | При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. Поэтому газовые законы и их следствия, как правило, не нарушаются лишь для разреженных реальных газов. То есть, для газов, расстояние между частицами которых ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально. |
| | | | |
| | Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют. | | Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют. |
| | | | |
| - | Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. В этом случае частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой. | + | Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. При таких обстоятельствах частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой. |
| | | | |
| | <h2>Уравнение состояния идеального газа</h2> | | <h2>Уравнение состояния идеального газа</h2> |
| | | | |
| - | А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, называют уравнением состояния идеального газа. | + | А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, принято называть уравнением состояния идеального газа. |
| | | | |
| | К таким нулевым параметрам, без которых невозможно определить состояние газа, является: | | К таким нулевым параметрам, без которых невозможно определить состояние газа, является: |
| Строка 26: |
Строка 22: |
| | • Второй параметр – это объем –V;<br> | | • Второй параметр – это объем –V;<br> |
| | • И к третьему параметру относится температура – Т.<br> | | • И к третьему параметру относится температура – Т.<br> |
| | + | Из предыдущего раздела нашего урока, мы уже знаем, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных. |
| | | | |
| - | Как вам уже известно, из предыдущего раздела нашего урока, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных.
| + | А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще принято называть уравнением Клапейрона-Менделеева. |
| - | | + | |
| - | А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще имеет и другое название, его еще называют уравнением Клапейрона-Менделеева. | + | |
| | | | |
| | Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа. | | Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа. |
| Строка 49: |
Строка 44: |
| | <br> | | <br> |
| | | | |
| - | Впервые уравнение, с помощью которого можно было установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот великий русский ученый Дмитрий Иванович Менделеев в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон. | + | Впервые уравнение, которое помогает установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот Дмитрий Иванович Менделеев, великий русский ученый, в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон. |
| | | | |
| | Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона. | | Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона. |
| | | | |
| - | Также, следует обратить внимание на то, что если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид: | + | Также, следует обратить внимание на то, что когда объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид: |
| | | | |
| | <br> | | <br> |
| - | [[Image:10kl_IdealGaz02.jpg|500x500px|уравнение газа]] | + | [[Image:10kl_IdealGaz02.jpg|300x500px|уравнение газа]] |
| | <br> | | <br> |
| | <br> | | <br> |
| Строка 62: |
Строка 57: |
| | <br> | | <br> |
| | | | |
| - | Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете представление о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям. | + | Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете понятие о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям. |
Текущая версия на 14:24, 6 сентября 2015
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Уравнение состояния идеального газа
Состояние идеального газа
Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Однако, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и соответственно они немного зависимы друг от друга.
При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. Поэтому газовые законы и их следствия, как правило, не нарушаются лишь для разреженных реальных газов. То есть, для газов, расстояние между частицами которых ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально.
Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют.
Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. При таких обстоятельствах частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой.
Уравнение состояния идеального газа
А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, принято называть уравнением состояния идеального газа.
К таким нулевым параметрам, без которых невозможно определить состояние газа, является:
• К первому параметру относится давление, которое обозначают символом - Р;
• Второй параметр – это объем –V;
• И к третьему параметру относится температура – Т.
Из предыдущего раздела нашего урока, мы уже знаем, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных.
А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще принято называть уравнением Клапейрона-Менделеева.
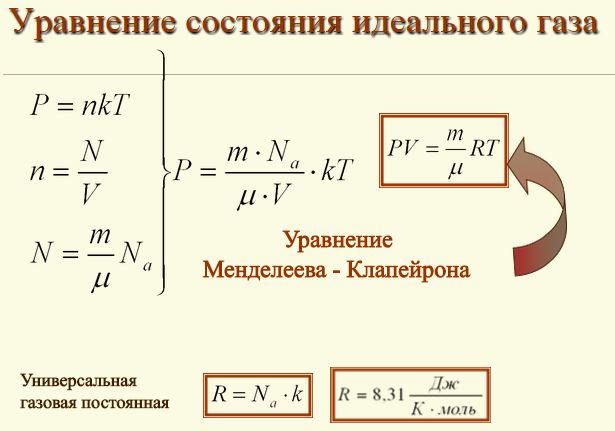
Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа.
PV = nRT
Такое уравнение и называется уравнением состояния идеального газа.
где:
n – является числом молей газа;
P – давление газа, Па;
V – объем газа, м3;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Впервые уравнение, которое помогает установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот Дмитрий Иванович Менделеев, великий русский ученый, в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон.
Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона.
Также, следует обратить внимание на то, что когда объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид:
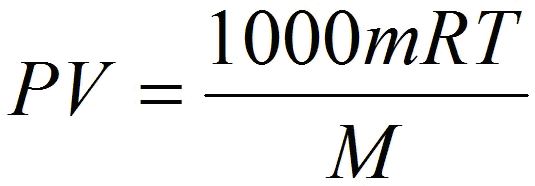

Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете понятие о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям.
|