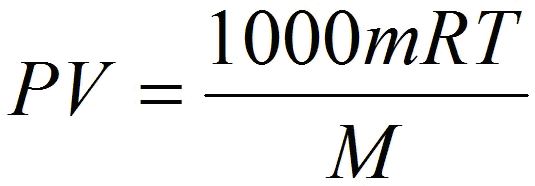Версия 12:22, 6 сентября 2015Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Уравнение состояния идеального газа
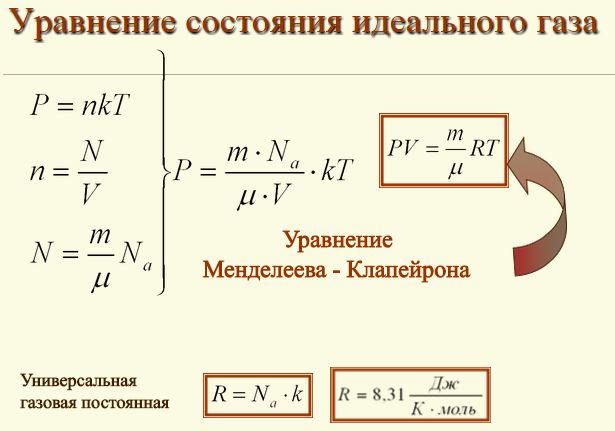
Состояние идеального газаСегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Но, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и поэтому имеют некую зависимость друг от друга. При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. В связи с этим газовые законы, а также следствия из них, как правило, не нарушаются только для разреженных реальных газов. То есть, для газов, у которых расстояние между частицами ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально. Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют. Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. В этом случае частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой. Уравнение состояния идеального газаА вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, называют уравнением состояния идеального газа. К таким нулевым параметрам, без которых невозможно определить состояние газа, является: • К первому параметру относится давление, которое обозначают символом - Р; Как вам уже известно, из предыдущего раздела нашего урока, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных. А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще имеет и другое название, его еще называют уравнением Клапейрона-Менделеева. Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа. PV = nRT Такое уравнение и называется уравнением состояния идеального газа. где: n – является числом молей газа; Впервые уравнение, с помощью которого можно было установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот великий русский ученый Дмитрий Иванович Менделеев в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон. Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона. Также, следует обратить внимание на то, что если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид: Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете представление о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: