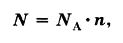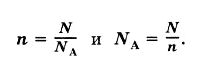|
|
|
| (2 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Количество вещества'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Количество вещества</metakeywords> | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Количество вещества'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Количество вещества</metakeywords> |
| | | | |
| - | ''Химия'' — это наука о веществах. А как измерять вещество? В каких единицах? Вы можете предложить отсчитывать необходимое число молекул вещества, если оно состоит из них. Однако сделать это чрезвычайно сложно. Некоторые из вас предложат измерять вещество в граммах, килограммах или миллиграммах. Но ведь это единицы намерения массы.
| + | <h2>Как измерить количество вещества?</h2> |
| | | | |
| - | <br>Для измерения вещества была выбрана особая единица, в которой как бы соединились число молекул и масса вещества. Эта единица была названа <u>''моль''</u>.<br>Чтобы отмерить один моль вещества, нужно взять столько граммов его. какова относительная атомиая (Аr) или относительная молекулярная масса (Mr) вещества.
| + | Всем нам известно, что химия является той наукой, которая изучает вещества. А интересовал ли вас когда-нибудь вопрос, каким способом можно измерить вещество и в каких единицах это лучше всего делать? Сразу оговорюсь, что такие варианты, как измерять вещество в граммах, килограммах или миллиграммах – не подходит, так как это единицы измерения массы. |
| | | | |
| - | <br>Например, один моль воды имеет массу, равную 18 г, так как Мr (Н20) - 18; один моль кислорода — 32 г, так как Мr(О2) = 32; один моль железа — 56 г, так как Мr(Fе) = 56.
| + | Но мы все прекрасно понимаем, что во всех химических процессах берут участие такие мельчайшие частицы, как молекулы, атомы, электроны и ионы. А так как вещество состоит из этих частиц, то может, неплохо было бы измерять вещество просто отсчитывать нужное число молекул? Но скажу наперед, что этот вариант не проходит, так это сделать довольно таки сложно. Ведь вам уже известно, что таких частиц в веществе просто огромное количество. |
| | | | |
| - | <br>А если нужно отмерить два моля воды, то сколько граммов ее нужно взять? Верно. 36 г (18 * 2). Л можно отмерить полмоля кислорода? Конечно. 0,5 моль О2 имеют массу в два раза меньше массы одного моля, то есть 16 г (32:2). Л сколько молей воды взято, если, например, отмерили 45 г воды? Очевидно, нужно эту массу разделить на массу одного моля воды (45 г : 18 г/моль = 2,5 моль), то есть взято 2.5 моль.
| + | И чтобы избежать математических манипуляций с большими числами и чтобы определить количество вещества, которое участвует в химической реакции, придумали специальную единицу, которую назвали моль, что в переводе с французского обозначает «множество». В этой особой единице в какой-то степени объединились и число молекул, и масса вещества. |
| | | | |
| - | <br>А как связано с количеством вещества число его молекул? Установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6 * 10^23 честь итальянского ученого А. Лвогадро это чисто назвали постоянной Авогадро. Обозначается оно N A. | + | <h2>Моль, молярная масса</h2> |
| | | | |
| - | <br>Таким образом, 1 моль воды имеет массу 18 г и содержит 6 * 10^23 молекул Н2О. Один моль кислорода О2 имеет массу 32 г и также содержит 6 * 10^23 молекул O2.
| + | А теперь рассмотрим измерение вещества в молях более подробно. Если мы с вами, например, хотим отмерить один моль вещества, то нам необходимо столько его граммов, сколько его относительная атомная масса (Аr.) вещества или же, относительная молекулярная масса (Mr) вещества. |
| | | | |
| - | [[Image:Him8-44.jpg]] | + | <br> |
| | + | [[Image:8kl_Kol.Vech01.jpg|500x500px|кол. вещества]] |
| | + | <br> |
| | | | |
| - | <br>
| + | Но чтобы было еще более понятно, давайте попробуем измерить массу вещества на конкретном примере. Так, к примеру, если: |
| - | | + | |
| - | Теперь дадим определение понятию "моль".
| + | |
| - | | + | |
| - | ----
| + | |
| - | | + | |
| - | <u>''Моль''</u> — это такое количество вещества, в котором содержится 6 * 10^23 молекул этого вещества.
| + | |
| - | | + | |
| - | ----
| + | |
| | | | |
| - | [[Image:Him8-45.jpg]]
| + | • 1 моль воды имеет массу, которая равна 18 г, то относительная молекулярная масса Мr(Н20) = 18; |
| | + | • 1 моль кислорода имеет массу, равную 32 г, так как Мr(02) = 32; |
| | + | • 1 моль железа имеет массу, равную 56 г, так как Mr(Fe) = 56. |
| | | | |
| | + | <br> |
| | + | [[Image:8kl_Kol.Vech02.jpg|500x500px|кол. вещества]] |
| | <br> | | <br> |
| | | | |
| - | Масса 1 моль вещества называется его молярной массой и обозначается буквой М.<br><br>Как вы теперь знаете, количество вещества измеряется в молях и обозначается буквой n, в некоторых учебниках — греческой буквой ''v'' (ню). Чтобы найти количество вещества, нужно его массу разделить на молярную массу:<br>[[Image:Him8-46.jpg]]
| + | То есть, из этого следует, что если нам необходимо отмерить 2 моль воды, то нам нужно 18 × 2 и мы получим 36 г. |
| | | | |
| - | <br>
| + | А как нам поступить, если нужно отмерять 0,5 моль кислорода? Здесь нам известно, что масса кислорода в два раза меньше массы 1 моль, значит нам нужно 32 : 2. и мы получим 16 г. |
| | | | |
| - | Вы Знаете, что единица массы, которая в 10041 раз больше одного грамма, называется килограммом, а единица массы в 1000 раз меньше одного грамма — милиграммом.
| + | А если было отмерено 45 г воды, то сколько молей воды нам нужно взять? Оказывается, что все очень просто и в этом случае нужно взять эту массу и разделить на массу 1 моль воды. То есть, мы берем 45 г, и делим их на 18 г/моль и в итоге получается, что мы взяли 2,5 моль. |
| | | | |
| - | <br>Следовательно, в количество вещества можно измерять не только в молях, но и в киломолях — к моль (1 кмоль содержит 1000 моль), и в миллимолях — ммоль (1 моль содержит 1000 ммоль).<br> | + | <h2>Какая связь количества вещества с числом его молекул?</h2> |
| | | | |
| - | Соответственно, вместо молярной массы в некоторых случаях удобнее пользоваться понятием киломолярная масса (кг/кмоль) и миляимолярная масса (мг/ммоль).
| + | Следует помнить, что один моль какого-либо вещества, всегда содержит одинаковое количество молекул, которой является очень удобная пропорция, равная: |
| | | | |
| - | <br>Мы определили, как связаны между собой количество и масса вещества. Теперь решим задачи с использованием рассмотренных выше понятий. | + | <br> |
| | + | [[Image:8kl_Kol.Vech03.jpg|100x100px|кол. вещества]] |
| | + | <br> |
| | + | |
| | + | Это число называется постоянной Авогадро, в честь итальянского ученого А. Авогадро. А обозначают эту постоянную NA. И в том случае, если N равняется числу частиц, а именно: |
| | | | |
| - | <br>''Задача 1.'' Сколько молекул содержится в 11 г углекислого газа СO2?<br> <br>[[Image:Him8-47.jpg]] | + | <br> |
| | + | [[Image:8kl_Kol.Vech03.jpg|100x100px|кол. вещества]] |
| | + | <br> |
| | + | |
| | + | то нам уже известно, что их вес равен весу этих частиц в а.е.м. |
| | | | |
| - | <br>
| + | Из этого всего следует, что 1 моль воды равен массе в 18 г и содержит 6 × 1023 молекул воды. |
| | | | |
| - | 1. Количество вещества. | + | Тогда, когда 1 моль кислорода 02 равен массе в 32 г и точно также содержит 6 × 1023 молекул кислорода. |
| | | | |
| - | 2. Моль, киломоль, миллимоль.<br> | + | А из этого можно сделать вывод, что в 2 моль воды и любого вещества насчитывается 12 × 1023 молекул, ну и естественно, что в 0,5 моль содержаться 3 × 1023 молекул. |
| | | | |
| - | 3. Молярная, киломолярная и миллимолярная массы.<br>
| + | Поэтому, для того чтобы узнать число молекул (N), которые присутствуют в определённом количестве вещества, необходимо воспользоваться такой формулой: |
| | | | |
| - | 4. Число Авогадро.<br>
| + | <br> |
| | + | [[Image:8kl_Kol.Vech04.jpg|150x150px|кол. вещества]] |
| | + | <br> |
| | + | |
| | + | в которой: |
| | | | |
| - | Сколько молекул содержит: а) 1 кмоль вещества; б) 1 ммоль вещества?
| + | N – указывает на число частиц;<br> |
| | + | ν – на количество вещества;<br> |
| | + | N A – это число Авогадро.<br> |
| | | | |
| - | [[Image:Him8-48.jpg]] | + | Следуя из этой формулы, будут верными и следующие неравенства: |
| | + | |
| | + | <br> |
| | + | [[Image:8kl_Kol.Vech05.jpg|300x200px|кол. вещества]] |
| | + | <br> |
| | | | |
| - | Вставьте пропущенные слова в предложения: «Масса измеряется в миллиграммах ... килограммах. Количество вещества измеряется в...<br><br>Плотность, то есть масса кислорода объемом 1 л. приблизительно равна 1,3 г/л. Какое количество вещества кислорода будет содержаться в 1 л его? Сколько молекул его будет в 1 л? а сколько в 1 мл? а в 1 м3?<br>
| + | <br> |
| | + | [[Image:8kl_Kol.Vech06.jpg|500x500px|кол. вещества]] |
| | + | <br> |
| | | | |
| - | <br><br> <sub>картинки и иллюстрации [[Химия|к уроку химии]], самая большая [[Гипермаркет знаний - первый в мире!|библиотека учебников]], уроки [[Химия 8 класс|химии]]</sub>
| + | Вот мы и подошли с вами к определению, из которого следует, что моль является тем количеством вещества, в котором содержаться 6 × 1023 молекул этого вещества. |
| | | | |
| - | '''<u>Содержание урока</u>'''
| + | Также, вам необходимо помнить, что в молях можно измерить не только число молекул, но и число атомов, ионов, электронов и т. д. |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас
| + | |
| | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%9A%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%BE_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%B0_(%D0%A5%D0%B8%D0%BC%D0%B8%D1%8F_8_%D0%BA%D0%BB%D0%B0%D1%81%D1%81)._%D0%9F%D1%80%D0%B5%D0%B7%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D1%8F презентация урока] | | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%9A%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%BE_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%B0_(%D0%A5%D0%B8%D0%BC%D0%B8%D1%8F_8_%D0%BA%D0%BB%D0%B0%D1%81%D1%81)._%D0%9F%D1%80%D0%B5%D0%B7%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D1%8F презентация урока] |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии
| |
| - |
| |
| - | '''<u>Практика</u>'''
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников
| |
| - |
| |
| - | '''<u>Иллюстрации</u>'''
| |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа '''
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты
| |
| - |
| |
| - | '''<u>Дополнения</u>'''
| |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты'''
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие
| |
| - |
| |
| - | <u>Совершенствование учебников и уроков
| |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике'''
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми
| |
| - |
| |
| - | '''<u>Только для учителей</u>'''
| |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки '''
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы
| |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения
| |
| - |
| |
| - |
| |
| - | '''<u>Интегрированные уроки</u>'''<u>
| |
| - | </u>
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| |
| - |
| |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| |
Текущая версия на 11:02, 6 сентября 2015
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Количество вещества
Как измерить количество вещества?
Всем нам известно, что химия является той наукой, которая изучает вещества. А интересовал ли вас когда-нибудь вопрос, каким способом можно измерить вещество и в каких единицах это лучше всего делать? Сразу оговорюсь, что такие варианты, как измерять вещество в граммах, килограммах или миллиграммах – не подходит, так как это единицы измерения массы.
Но мы все прекрасно понимаем, что во всех химических процессах берут участие такие мельчайшие частицы, как молекулы, атомы, электроны и ионы. А так как вещество состоит из этих частиц, то может, неплохо было бы измерять вещество просто отсчитывать нужное число молекул? Но скажу наперед, что этот вариант не проходит, так это сделать довольно таки сложно. Ведь вам уже известно, что таких частиц в веществе просто огромное количество.
И чтобы избежать математических манипуляций с большими числами и чтобы определить количество вещества, которое участвует в химической реакции, придумали специальную единицу, которую назвали моль, что в переводе с французского обозначает «множество». В этой особой единице в какой-то степени объединились и число молекул, и масса вещества.
Моль, молярная масса
А теперь рассмотрим измерение вещества в молях более подробно. Если мы с вами, например, хотим отмерить один моль вещества, то нам необходимо столько его граммов, сколько его относительная атомная масса (Аr.) вещества или же, относительная молекулярная масса (Mr) вещества.
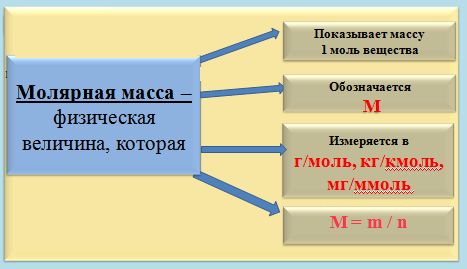
Но чтобы было еще более понятно, давайте попробуем измерить массу вещества на конкретном примере. Так, к примеру, если:
• 1 моль воды имеет массу, которая равна 18 г, то относительная молекулярная масса Мr(Н20) = 18;
• 1 моль кислорода имеет массу, равную 32 г, так как Мr(02) = 32;
• 1 моль железа имеет массу, равную 56 г, так как Mr(Fe) = 56.
То есть, из этого следует, что если нам необходимо отмерить 2 моль воды, то нам нужно 18 × 2 и мы получим 36 г.
А как нам поступить, если нужно отмерять 0,5 моль кислорода? Здесь нам известно, что масса кислорода в два раза меньше массы 1 моль, значит нам нужно 32 : 2. и мы получим 16 г.
А если было отмерено 45 г воды, то сколько молей воды нам нужно взять? Оказывается, что все очень просто и в этом случае нужно взять эту массу и разделить на массу 1 моль воды. То есть, мы берем 45 г, и делим их на 18 г/моль и в итоге получается, что мы взяли 2,5 моль.
Какая связь количества вещества с числом его молекул?
Следует помнить, что один моль какого-либо вещества, всегда содержит одинаковое количество молекул, которой является очень удобная пропорция, равная:
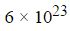
Это число называется постоянной Авогадро, в честь итальянского ученого А. Авогадро. А обозначают эту постоянную NA. И в том случае, если N равняется числу частиц, а именно:
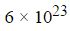
то нам уже известно, что их вес равен весу этих частиц в а.е.м.
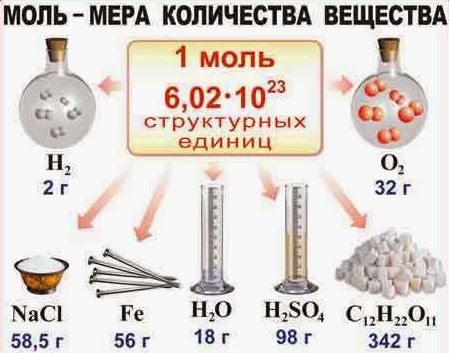
Из этого всего следует, что 1 моль воды равен массе в 18 г и содержит 6 × 1023 молекул воды.
Тогда, когда 1 моль кислорода 02 равен массе в 32 г и точно также содержит 6 × 1023 молекул кислорода.
А из этого можно сделать вывод, что в 2 моль воды и любого вещества насчитывается 12 × 1023 молекул, ну и естественно, что в 0,5 моль содержаться 3 × 1023 молекул.
Поэтому, для того чтобы узнать число молекул (N), которые присутствуют в определённом количестве вещества, необходимо воспользоваться такой формулой:
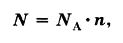
в которой:
N – указывает на число частиц;
ν – на количество вещества;
N A – это число Авогадро.
Следуя из этой формулы, будут верными и следующие неравенства:
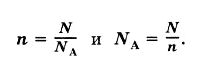
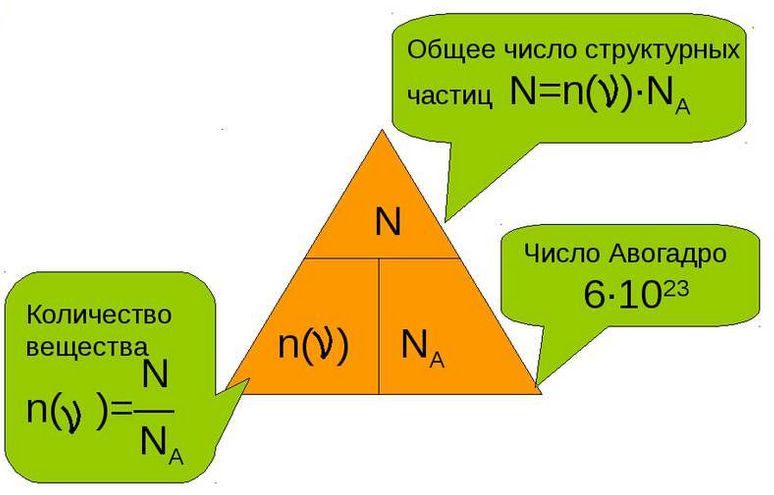
Вот мы и подошли с вами к определению, из которого следует, что моль является тем количеством вещества, в котором содержаться 6 × 1023 молекул этого вещества.
Также, вам необходимо помнить, что в молях можно измерить не только число молекул, но и число атомов, ионов, электронов и т. д.
 презентация урока презентация урока
|