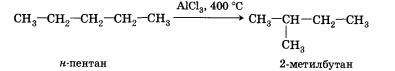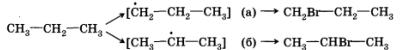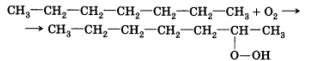|
|
|
| (2 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Алканы<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Алканы</metakeywords>''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Алканы<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Алканы</metakeywords>''' |
| | | | |
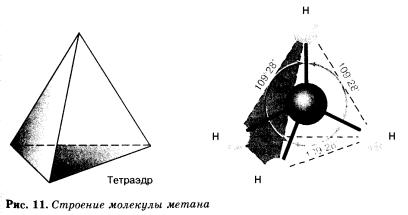
| - | Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле С<sub>n</sub>Н<sub>2n+2</sub>.<br>В молекулах алканов все атомы углерода находятся в состоянии sр<sup>3</sup>-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28' (рис. 11).<br>[[Image:aahim10-49.jpg]]<br>
| + | <h2>Алканы. Определение. Общие сведения</h2> |
| | | | |
| - | <br> | + | Алканы — [[Предельные_углеводороды|углеводороды]], в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле С<sub>n</sub>Н<sub>2n+2</sub>.<br>В молекулах алканов все атомы углерода находятся в состоянии sр<sup>3</sup>-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28' (рис. 11).<br>[[Image:Aahim10-49.jpg|молекула метана]]<br> |
| | | | |
| - | Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму. В развернутом состоянии такие молекулы имеют зигзагообразную форму с углами при атомах углерода, близких к тетраэдрическому (109°280, например в молекуле ''н''-пентана.<br><br>Особо стоит напомнить о связях, при помощи которых построены молекулы алканов. Все связи в молекулах алканов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это Þ-связи. Связи углерод—углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм. Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.<br><br>Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.<br>''<br>Гомологический ряд метана''<br><br>Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.<br><br>Предельные углеводороды составляют гомологический ряд метана.<br><br>
| + | <br> |
| | | | |
| - | ''Изомерия и номенклатура''<br><br>Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан.<br><br>Основы номенклатуры ИЮПАК уже обсуждались. В этой части параграфа она будет рассмотрена подробнее для алканов.<br><br>1. Выбор главной цепи<br><br>Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.<br><br>2. Нумерация атомов главной цепи<br><br>Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: летил (—СН3), затем пропил (—СН2—СН2—СН3), этил (—СН2—СН3) и т. д.<br><br>Обратите внимание, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.<br><br>3. Формирование названия<br><br>В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).<br>[[Image:aahim10-50.jpg]]<br>
| + | Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму. В развернутом состоянии такие молекулы имеют зигзагообразную форму с углами при атомах [[Углерод_(Химия_9_класс)|углерода]], близких к тетраэдрическому (109°280, например в молекуле ''н''-пентана.<br><br>Особо стоит напомнить о связях, при помощи которых построены молекулы алканов. Все связи в молекулах алканов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это Þ-связи. Связи углерод—углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм. Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.<br><br>Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов. |
| | | | |
| - | <br> | + | <br><h4>Гомологический ряд метана</h4> |
| | + | |
| | + | <br><br>Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.<br><br>Предельные углеводороды составляют гомологический ряд метана.<br><br> |
| | + | |
| | + | <br><h4>Изомерия и номенклатура</h4> |
| | + | |
| | + | Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные [[Явище_ізомерії._Структурна_ізомерія,_номенклатура_насичених_вуглеводнів|изомеры]], — это бутан.<br><br>Основы номенклатуры ИЮПАК уже обсуждались. В этой части параграфа она будет рассмотрена подробнее для алканов.<br><br>1. Выбор главной цепи<br><br>Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.<br><br>2. Нумерация атомов главной цепи<br><br>Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: летил (—СН3), затем пропил (—СН2—СН2—СН3), этил (—СН2—СН3) и т. д.<br><br>Обратите внимание, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.<br><br>3. Формирование названия<br><br>В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).<br>[[Image:Aahim10-50.jpg|Алканы]]<br> |
| | + | |
| | + | <br> |
| | | | |
| | Названия веществ, структурные формулы которых приведены выше, следующие:<br><br>структура А 2-метилбутан | | Названия веществ, структурные формулы которых приведены выше, следующие:<br><br>структура А 2-метилбутан |
| | | | |
| - | структура Б З-метилгексан <br> | + | структура Б З-метилгексан <br> |
| | | | |
| - | структура В 2,2,4-тприметилпентап <br> | + | структура В 2,2,4-тприметилпентап <br> |
| | | | |
| - | структура Г З-метил-5-этилтептан<br><br>''Получение''<br><br>1. Выделение углеводородов из природного сырья. Источниками предельных углеводородов, как вы уже знаете, являются нефть и природный газ.<br><br>Основной компонент природного газа — простейший углеводород метан, который используется непосредственно или подвергается переработке.<br><br>Нефть, извлеченная из земных недр, также подвергается переработке, ректификации, крекингу.<br><br>Больше всего углеводородов получают при переработке нефти и других природных источников. Но значительное количество ценных углеводородов получают искусственно, синтетическими способами.<br><br>2. Изомеризация. Наличие катализаторов изомеризации ускоряет образование углеводородов с разветвленным скелетом из линейных углеводородов:<br><br>[[Image:aahim10-51.jpg]] | + | структура Г З-метил-5-этилтептан<br> |
| | | | |
| - | <br> | + | <br><h4>Получение</h4> |
| | | | |
| - | Добавление катализаторов позволяет несколько уменьшить температуру, при которой протекает реакция.<br><br>3. Гидрирование (присоединение водорода) алкенов. Как уже было сказано, в результате крекинга образуется большое количество непредельных углеводородов с двойной связью — алкенов. Уменьшить их количество можно, добавив в систему водород и катализаторы гидрирования — металлы (платина, палладий, никель):<br><br>СН3 - СН2 - СН = СН2 + Н2 -> СН3 - СН2 - СН2 - СН3<br><br>Крекинг в присутствии катализаторов гидрирования с добавлением водорода называется восстановительным крекингом. Основными его продуктами являются предельные углеводороды.<br><br>В заключение добавим, что повышение давления при крекинге (крекинг высокого давления) позволяет уменьшить количество газообразных (СН4—С4Н10) углеводородов и повысить содержание жидких углеводородов с длиной цепи 6—10 атомов углерода, которые составляют основу бензинов.<br><br>Мы рассмотрели несколько промышленных способов получения алканов, которые являются основой промышленной переработки основного углеводородного сырья — нефти.<br><br>Теперь обсудим несколько лабораторных способов получения алканов.<br><br>4. Декарбоксилирование натриевых солей карбоновых кислот.<br><br>Нагревание натриевой соли уксусной кислоты (ацетата натрия) с избытком щелочи приводит к отщеплению карбоксильной группы и образованию метана:<br><br>СН3СОNа + NаОН СН4 + Nа2С03<br><br>Если вместо ацетата натрия взять пропионат натрия, то образуется этан, из бутаноата натрия — пропан и т. д.<br><br>RСН2СОNа +NаОН -> RСН3 + Nа2С03<br><br>5. Синтез Вюрца. При взаимодействии галогеналканов с щелочным металлом натрием образуются предельные углеводороды и галогенид щелочного металла, например:<br><br>2СН3СН2Вг + 2Nа —»>СН3СН2СН2СН3 + 2NаВг<br><br>Действие щелочного металла на смесь галогенуглеводородов (например, бромэтана и бромметана) приведет к образованию смеси алканов (этана, пропана и бутана).<br><br>Реакция, на которой основан синтез Вюрца, хорошо протекает только с галогеналканами, в молекулах которых атом галогена присоединен к первичному атому углерода.<br><br>6. Гидролиз карбидов. При обработке некоторых карбидов, содержащих углерод в степени окисления -4 (например, карбида алюминия), водой образуется метан:<br><br>Аl4С3 + 12Н20 = ЗСН4 + 4Аl(ОН)3 Физические свойства<br><br>Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который надо звонить по телефону 04, определяется запахом меркаптанов — серусодер-жащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).<br><br>Углеводороды состава от С5Н12 до С15Н32 — жидкости, более тяжелые углеводороды — твердые вещества.<br><br>Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.<br><br>
| + | 1. Выделение углеводородов из природного сырья. Источниками предельных углеводородов, как вы уже знаете, являются нефть и природный газ.<br><br>Основной компонент природного газа — простейший углеводород метан, который используется непосредственно или подвергается переработке.<br><br>Нефть, извлеченная из земных недр, также подвергается переработке, ректификации, крекингу.<br><br>Больше всего углеводородов получают при переработке нефти и других природных источников. Но значительное количество ценных углеводородов получают искусственно, синтетическими способами.<br><br>2. Изомеризация. Наличие катализаторов изомеризации ускоряет образование углеводородов с разветвленным скелетом из линейных углеводородов:<br><br>[[Image:Aahim10-51.jpg|Алканы]] |
| | | | |
| - | ''Химические свойства''<br><br>1. Реакции замещения. Наиболее характерными для ал-канов являются реакции свободнорадикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо группу.<br><br>Приведем уравнения наиболее характерных реакций.<br><br>Галогенирование:<br><br>СН4 + С12 —> СН3Сl + HCl<br><br>В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:<br><br>СН3Сl + С12 —> HCl + СН2Сl2<br>дихлорметан хлористый метилен<br><br>СН2Сl2 + Сl2 —> HCl + CHCl3<br>трихлорметан хлороформ<br><br>СНСl3 + Сl2 —> HCl + ССl4<br>тетрахлорметан четыреххлористый углерод<br><br>Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.<br><br>2. Дегидрирование (отщепление водорода). При пропускании алканов над катализатором (Pt, Ni, А1203, Сг2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:<br><br>СН3—СН3 —> СН2=СН2 + Н2<br><br>3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнора-дикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива.<br><br>СН4 + 2O2 —> С02 + 2Н2O + 880кДж<br><br>
| + | <br> |
| | | | |
| - | В общем виде реакцию горения алканов можно записать следующим образом:<br> | + | Добавление катализаторов позволяет несколько уменьшить температуру, при которой протекает реакция.<br><br>3. Гидрирование (присоединение водорода) [[Алкены|алкенов]]. Как уже было сказано, в результате крекинга образуется большое количество непредельных углеводородов с двойной связью — алкенов. Уменьшить их количество можно, добавив в систему водород и катализаторы гидрирования — металлы (платина, палладий, никель):<br><br>СН3 - СН2 - СН = СН2 + Н2 -> СН3 - СН2 - СН2 - СН3<br><br>Крекинг в присутствии катализаторов гидрирования с добавлением водорода называется восстановительным крекингом. Основными его продуктами являются предельные углеводороды.<br><br>В заключение добавим, что повышение давления при крекинге (крекинг высокого давления) позволяет уменьшить количество газообразных (СН4—С4Н10) углеводородов и повысить содержание жидких углеводородов с длиной цепи 6—10 атомов углерода, которые составляют основу бензинов.<br><br>Мы рассмотрели несколько промышленных способов получения алканов, которые являются основой промышленной переработки основного углеводородного сырья — нефти.<br><br>Теперь обсудим несколько лабораторных способов получения алканов.<br><br>4. Декарбоксилирование натриевых солей карбоновых [[Кислоты._Полные_уроки|кислот]].<br><br>Нагревание натриевой соли уксусной кислоты (ацетата натрия) с избытком щелочи приводит к отщеплению карбоксильной группы и образованию метана:<br><br>СН3СОNа + NаОН СН4 + Nа2С03<br><br>Если вместо ацетата натрия взять пропионат натрия, то образуется этан, из бутаноата натрия — пропан и т. д.<br><br>RСН2СОNа +NаОН -> RСН3 + Nа2С03<br><br>5. Синтез Вюрца. При взаимодействии галогеналканов с щелочным металлом натрием образуются предельные углеводороды и галогенид щелочного металла, например:<br><br>2СН3СН2Вг + 2Nа —»>СН3СН2СН2СН3 + 2NаВг<br><br>Действие щелочного металла на смесь галогенуглеводородов (например, бромэтана и бромметана) приведет к образованию смеси алканов (этана, пропана и бутана).<br><br>Реакция, на которой основан синтез Вюрца, хорошо протекает только с галогеналканами, в молекулах которых атом галогена присоединен к первичному атому углерода.<br><br>6. Гидролиз карбидов. При обработке некоторых карбидов, содержащих углерод в степени окисления -4 (например, карбида алюминия), водой образуется метан:<br><br>Аl4С3 + 12Н20 = ЗСН4 + 4Аl(ОН)3 Физические свойства<br><br>Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который надо звонить по телефону 04, определяется запахом меркаптанов — серусодер-жащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).<br><br>Углеводороды состава от С5Н12 до С15Н32 — жидкости, более тяжелые углеводороды — твердые вещества.<br><br>Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.<br><br> |
| | | | |
| - | [[Image:aahim10-52.jpg]]<br>
| + | <h2>Химические свойства</h2> |
| | | | |
| - | <br> | + | 1. Реакции замещения. Наиболее характерными для ал-канов являются реакции свободнорадикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо группу.<br><br>Приведем уравнения наиболее характерных реакций.<br><br>Галогенирование:<br><br>СН4 + С12 —> СН3Сl + HCl<br><br>В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:<br><br>СН3Сl + С12 —> HCl + СН2Сl2<br>дихлорметан хлористый метилен<br><br>СН2Сl2 + Сl2 —> HCl + CHCl3<br>трихлорметан хлороформ<br><br>СНСl3 + Сl2 —> HCl + ССl4<br>тетрахлорметан четыреххлористый углерод<br><br>Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.<br><br>2. Дегидрирование (отщепление водорода). При пропускании алканов над катализатором (Pt, Ni, А1203, Сг2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:<br><br>СН3—СН3 —> СН2=СН2 + Н2<br><br>3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнора-дикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива.<br><br>СН4 + 2O2 —> С02 + 2Н2O + 880кДж<br><br> |
| | | | |
| - | Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.<br><br>При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества. При нагревании до температуры 1500 °С возможно образование ацетилена.<br><br>4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:<br>[[Image:aahim10-53.jpg]]<br>
| + | В общем виде реакцию горения алканов можно записать следующим образом:<br> |
| | | | |
| - | <br> | + | [[Image:Aahim10-52.jpg|Алканы]]<br> |
| | | | |
| - | 5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:<br>[[Image:aahim10-54.jpg]]<br>
| + | <br> |
| | | | |
| - | <br>В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии sр<sup>3</sup>-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод—углерод) связей и слабополярных С—Н (углерод—водород) связей. В них нет участков с повышенной и пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних воздействий (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, так как связи в молекулах алканов не разрываются по гетеролитическому механизму.<br><br>Наиболее характерными реакциями алканов являются реакции свободнорадикального замещения. В ходе этих реакций атом водорода замещается на атом галогена или какую-либо группу.<br><br>Кинетику и механизм свободнорадикальных цепных реакций, т. е. реакций, протекающих под действием свободных радикалов — частиц, имеющих неспаренные электроны, — изучал замечательный русский химик Н. Н. Семенов. Именно за эти исследования ему была присуждена Нобелевская премия по химии.<br><br>Обычно механизм реакции свободнорадикального замещения представляют тремя основными стадиями:<br><br>1. Инициирование (зарождение цепи, образование свободных радикалов под действием источника энергии — ультрафиолетового света, нагревания).<br><br>2. Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые радикалы и новые молекулы).<br><br>3. Обрыв цепи (объединение свободных радикалов в неактивные молекулы (рекомбинация), «гибель» радикалов, прекращение развития цепи реакций).<br><br>
| + | Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.<br><br>При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества. При нагревании до температуры 1500 °С возможно образование ацетилена.<br><br>4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:<br>[[Image:Aahim10-53.jpg|Алканы]]<br> |
| | | | |
| - | Семенов Николай Николаевич<br>
| + | <br> |
| | | | |
| - | (1896 - 1986)<br>
| + | 5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:<br>[[Image:Aahim10-54.jpg|Алканы]]<br> |
| | | | |
| - | [[Image:aahim10-55.jpg]]<br>
| + | <br>В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии sр<sup>3</sup>-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод—углерод) связей и слабополярных С—Н (углерод—водород) связей. В них нет участков с повышенной и пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних воздействий (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, так как связи в молекулах алканов не разрываются по гетеролитическому механизму.<br><br>Наиболее характерными реакциями алканов являются реакции свободнорадикального замещения. В ходе этих реакций атом водорода замещается на атом галогена или какую-либо группу.<br><br>Кинетику и механизм свободнорадикальных цепных реакций, т. е. реакций, протекающих под действием свободных радикалов — частиц, имеющих неспаренные электроны, — изучал замечательный русский химик Н. Н. Семенов. Именно за эти исследования ему была присуждена Нобелевская премия по [[Соли_аммония_(Химия_9_класс)|химии]].<br><br>Обычно механизм реакции свободнорадикального замещения представляют тремя основными стадиями:<br><br>1. Инициирование (зарождение цепи, образование свободных радикалов под действием источника энергии — ультрафиолетового света, нагревания).<br><br>2. Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые радикалы и новые молекулы).<br><br>3. Обрыв цепи (объединение свободных радикалов в неактивные молекулы (рекомбинация), «гибель» радикалов, прекращение развития цепи реакций).<br><br> |
| | | | |
| - | Советский физик и физикохимик, академик. Лауреат Нобелевской премии (1956). Научные исследования относятся к учению о химических процессах, катализе, цепных реакциях, теории теплового взрыва и горении газовых смесей.<br><br>
| + | <h2>Научные исследования Н.Н. Семенова</h2> |
| | | | |
| - | Рассмотрим этот механизм на примере реакции хлорирования метана:<br><br>СН4 + Сl2 —> СН3Сl + НСl<br><br>Инициирование цепи происходит в результате того, что под действием ультрафиолетового облучения или при нагревании происходит гомолитический разрыв связи Сl—Сl и молекула хлора распадается на атомы:<br><br>Сl: Сl —> Сl· + Сl·<br><br>Образовавшиеся свободные радикалы атакуют молекулы метана, отрывая у них атом водорода:<br><br>СН4 + Сl· —> СН3· + НСl<br><br>и превращая в радикалы СН3·, которые, в свою очередь, сталкиваясь с молекулами хлора, разрушают их с образованием новых радикалов:<br><br>СН3· + Сl2 —> СН3Сl + Сl· и т. д.<br><br>Происходит развитие цепи.<br><br>Наряду с образованием радикалов происходит их «гибель» в результате процесса рекомбинации — образования неактивной молекулы из двух радикалов:<br><br>СН3· + Сl· —> СН3Сl
| + | Семенов Николай Николаевич<br> |
| | | | |
| - | Сl· + Сl· —> Сl2<br><br>СН3· + СН3· —> СН3—СН3<br><br>Интересно отметить, что при рекомбинации выделяется ровно столько энергии, сколько необходимо для разрушения только что образовавшейся связи. В связи с этим рекомбинация возможна только в том случае, если в соударении двух радикалов участвует третья частица (другая молекула, стенка реакционного сосуда), которая забирает на себя избыток энергии. Это дает возможность регулировать и даже останавливать свободнорадикальные цепные реакции.<br><br>Обратите внимание на последний пример реакции рекомбинации — образование молекулы этана. Этот пример показывает, что реакция с участием органических соединений представляет собой достаточно сложный процесс, в результате которого, наряду с основным продуктом реакции, очень часто образуются побочные продукты, что приводит к необходимости разрабатывать сложные и дорогостоящие методики очистки и выделения целевых веществ.<br><br>В реакционной смеси, полученной при хлорировании метана, наряду с хлорметаном (СН3Сl) и хлороводородом, будут содержаться: дихлорметан (СН2Сl2), трихлорметан (СНСl3), тетрахлорметан (ССl4), этан и продукты его хлорирования.<br><br>Теперь попытаемся рассмотреть реакцию галогенирования (например, бромирования) более сложного органического соединения — пропана.<br><br>Если в случае хлорирования метана возможно только одно моно-хлорпроизводное, то в этой реакции может образоваться уже два монобромпроизводных:<br>[[Image:aahim10-56.jpg]]<br>
| + | (1896 - 1986)<br> |
| | | | |
| - | <br> | + | [[Image:Aahim10-55.jpg|семенов николай]]<br> |
| | | | |
| - | Видно, что в первом случае происходит замещение атома водорода при первичном атоме углерода, а во втором — при вторичном. Одинаковы ли скорости этих реакций? Оказывается, что в конечной смеси преобладает продукт замещения атома водорода, который находится при вторичном углероде, т. е. 2-бромпропан (СН3—СНВг—СН3). Давайте попытаемся объяснить это.<br><br>Для того чтобы это сделать, нам придется воспользоваться представлением об устойчивости промежуточных частиц. Вы обратили внимание, что при описании механизма реакции хлорирования метана мы упомянули радикал метил — СН3·? Этот радикал является промежуточной частицей между метаном СН4 и хлорметаном СН3Сl. Промежуточной частицей между пропаном и 1-бромпропаном является радикал с неспаренным электроном при первичном углероде, а между пропаном и 2-бромпропаном — при вторичном.<br>[[Image:aahim10-57.jpg]]
| + | Советский физик и физикохимик, академик. Лауреат Нобелевской премии (1956). Научные исследования относятся к учению о химических процессах, катализе, цепных реакциях, теории теплового взрыва и горении газовых смесей.<br><br> |
| | | | |
| | + | Рассмотрим этот механизм на примере реакции хлорирования метана:<br><br>СН4 + Сl2 —> СН3Сl + НСl<br><br>Инициирование цепи происходит в результате того, что под действием ультрафиолетового облучения или при нагревании происходит гомолитический разрыв связи Сl—Сl и молекула хлора распадается на атомы:<br><br>Сl: Сl —> Сl· + Сl·<br><br>Образовавшиеся свободные радикалы атакуют молекулы метана, отрывая у них атом водорода:<br><br>СН4 + Сl· —> СН3· + НСl<br><br>и превращая в радикалы СН3·, которые, в свою очередь, сталкиваясь с молекулами хлора, разрушают их с образованием новых радикалов:<br><br>СН3· + Сl2 —> СН3Сl + Сl· и т. д.<br><br>Происходит развитие цепи.<br><br>Наряду с образованием радикалов происходит их «гибель» в результате процесса рекомбинации — образования неактивной молекулы из двух радикалов:<br><br>СН3· + Сl· —> СН3Сl |
| | | | |
| | + | Сl· + Сl· —> Сl2<br><br>СН3· + СН3· —> СН3—СН3<br><br>Интересно отметить, что при рекомбинации выделяется ровно столько энергии, сколько необходимо для разрушения только что образовавшейся связи. В связи с этим рекомбинация возможна только в том случае, если в соударении двух радикалов участвует третья частица (другая молекула, стенка реакционного сосуда), которая забирает на себя избыток энергии. Это дает возможность регулировать и даже останавливать свободнорадикальные цепные реакции.<br><br>Обратите внимание на последний пример реакции рекомбинации — образование молекулы этана. Этот пример показывает, что реакция с участием органических соединений представляет собой достаточно сложный процесс, в результате которого, наряду с основным продуктом реакции, очень часто образуются побочные продукты, что приводит к необходимости разрабатывать сложные и дорогостоящие методики очистки и выделения целевых веществ.<br><br>В реакционной смеси, полученной при хлорировании метана, наряду с хлорметаном (СН3Сl) и хлороводородом, будут содержаться: дихлорметан (СН2Сl2), трихлорметан (СНСl3), тетрахлорметан (ССl4), этан и продукты его хлорирования.<br><br>Теперь попытаемся рассмотреть реакцию галогенирования (например, бромирования) более сложного органического соединения — пропана.<br><br>Если в случае хлорирования метана возможно только одно моно-хлорпроизводное, то в этой реакции может образоваться уже два монобромпроизводных:<br>[[Image:Aahim10-56.jpg|Алканы]]<br> |
| | | | |
| - | Радикал с неспаренным электроном при вторичном атоме углерода (б) является более устойчивым по сравнению со свободным радикалом с неспаренным электроном при первичном атоме углерода (а). Он и образуется в большем количестве. По этой причине основным продуктом реакции бромирования пропана является 2-бром-пропан — соединение, образование которого протекает через более устойчивую промежуточную частицу.<br><br>Приведем несколько примеров свободнорадикальных реакций:<br><br>Реакция нитрования (реакция Коновалова)<br>[[Image:aahim10-58.jpg]]
| + | <br> |
| | | | |
| | + | Видно, что в первом случае происходит замещение атома водорода при первичном атоме углерода, а во втором — при вторичном. Одинаковы ли скорости этих реакций? Оказывается, что в конечной смеси преобладает продукт замещения атома водорода, который находится при вторичном углероде, т. е. 2-бромпропан (СН3—СНВг—СН3). Давайте попытаемся объяснить это.<br><br>Для того чтобы это сделать, нам придется воспользоваться представлением об устойчивости промежуточных частиц. Вы обратили внимание, что при описании механизма реакции хлорирования метана мы упомянули радикал метил — СН3·? Этот радикал является промежуточной частицей между метаном СН4 и хлорметаном СН3Сl. Промежуточной частицей между пропаном и 1-бромпропаном является радикал с неспаренным электроном при первичном углероде, а между пропаном и 2-бромпропаном — при вторичном.<br>[[Image:Aahim10-57.jpg|Алканы]] |
| | | | |
| | + | <br> |
| | + | |
| | + | Радикал с неспаренным электроном при вторичном атоме углерода (б) является более устойчивым по сравнению со свободным радикалом с неспаренным электроном при первичном атоме углерода (а). Он и образуется в большем количестве. По этой причине основным продуктом реакции бромирования пропана является 2-бром-пропан — соединение, образование которого протекает через более устойчивую промежуточную частицу.<br><br>Приведем несколько примеров свободнорадикальных реакций:<br><br>Реакция нитрования (реакция Коновалова)<br>[[Image:Aahim10-58.jpg|Алканы]] |
| | + | |
| | + | <br> |
| | | | |
| | Реакция применяется для получения нитросоединений — растворителей, исходных веществ для многих синтезов.<br><br>Каталитическое окисление алканов кислородом<br><br>Эти реакции являются основой важнейших промышленных процессов получения альдегидов, кетонов, спиртов непосредственно из предельных углеводородов, например:<br><br>СН4 + [О] —> СН3ОН | | Реакция применяется для получения нитросоединений — растворителей, исходных веществ для многих синтезов.<br><br>Каталитическое окисление алканов кислородом<br><br>Эти реакции являются основой важнейших промышленных процессов получения альдегидов, кетонов, спиртов непосредственно из предельных углеводородов, например:<br><br>СН4 + [О] —> СН3ОН |
| | | | |
| - | ''Применение''<br><br>Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.<br><br>Соединения, полученные из метана, самого дешевого углеводородного сырья, применяют для получения множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений.<br>[[Image:aahim10-59.jpg]] | + | '''Применение'''<br><br>Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.<br><br>Соединения, полученные из метана, самого дешевого углеводородного сырья, применяют для получения множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений.<br>[[Image:Aahim10-59.jpg|применение метана]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Углеводороды более высококипящих фракций нефти используются как горючее для дизельных, турбореактивных двигателей, как основа смазочных масел, как сырье для производства синтетических жиров и т. д.<br><br>Приведем несколько промышленно значимых реакций, протекающих с участием метана. Метан используют для получения хлороформа, нитрометана, кислородсодержащих производных. Спирты, альдегиды, карбоновые кислоты могут образовываться при непосредственном взаимодействии алканов с кислородом в зависимости от условий проведения реакций (катализатора, температуры, давления):<br>[[Image:Aahim10-60.jpg|Алканы]] |
| | | | |
| - | Углеводороды более высококипящих фракций нефти используются как горючее для дизельных, турбореактивных двигателей, как основа смазочных масел, как сырье для производства синтетических жиров и т. д.<br><br>Приведем несколько промышленно значимых реакций, протекающих с участием метана. Метан используют для получения хлороформа, нитрометана, кислородсодержащих производных. Спирты, альдегиды, карбоновые кислоты могут образовываться при непосредственном взаимодействии алканов с кислородом в зависимости от условий проведения реакций (катализатора, температуры, давления):<br>[[Image:aahim10-60.jpg]]
| + | <br> |
| | | | |
| | + | Как вы уже знаете, углеводороды состава от С5Н12 до С11Н24 входят в бензиновую фракцию нефти и применяются в основном как горючее для двигателей внутреннего сгорания. Известно, что наиболее ценными компонентами бензина являются изомерные углеводороды, так как они обладают максимальной детонационной устойчивостью.<br><br>Углеводороды при контакте с кислородом воздуха медленно образуют с ним соединения — перекиси. Это медленно протекающая свободнорадикальная реакция, инициатором которой является молекула кислорода:<br>[[Image:Aahim10-61.jpg|Алканы]] |
| | | | |
| | + | <br> |
| | | | |
| - | Как вы уже знаете, углеводороды состава от С5Н12 до С11Н24 входят в бензиновую фракцию нефти и применяются в основном как горючее для двигателей внутреннего сгорания. Известно, что наиболее ценными компонентами бензина являются изомерные углеводороды, так как они обладают максимальной детонационной устойчивостью.<br><br>Углеводороды при контакте с кислородом воздуха медленно образуют с ним соединения — перекиси. Это медленно протекающая свободнорадикальная реакция, инициатором которой является молекула кислорода:<br>[[Image:aahim10-61.jpg]]
| + | Обратите внимание на то, что гидропероксидная группа образуется при вторичных атомах углерода, которых больше всего в линейных, или нормальных, углеводородах.<br><br>При резком повышении давления и температуры, происходящем в конце такта сжатия, начинается разложение этих перекисных соединений с образованием большого числа свободных радикалов, которые «запускают» свободнорадикальную цепную реакцию горения раньше, чем это необходимо. Поршень еще идет вверх, а продукты горения бензина, которые уже успели образоваться в результате преждевременного поджига смеси, толкают его вниз. Это приводит к резкому уменьшению мощности двигателя, его износу.<br><br>Таким образом, основной причиной детонации является наличие перекисных соединений, способность образовывать которые максимальна у линейных углеводородов.<br><br>Наименьшей детонационной устойчивостью среди углеводородов бензиновой фракции (С5Н14 — С11Н24) обладает к-гептан. Наиболее устойчив (т. е. в наименьшей степени образует перекиси) так называемый изооктан (2,2,4-триметилпентан).<br><br>Общепринятой характеристикой детонационной устойчивости бензина является октановое число. Октановое число 92 (например, бензин А-92) означает, что данный бензин обладает теми же свойствами, что и смесь, состоящая из 92% изооктана и 8% гептана.<br><br>В заключение можно добавить, что использование высокооктанового бензина дает возможность повысить степень сжатия (давление в конце такта сжатия), что приводит к повышению мощности и КПД двигателя внутреннего сгорания. |
| | | | |
| | + | <h2>Нахождение в природе и получение</h2> |
| | | | |
| | + | На сегодняшнем уроке вы познакомились с таким понятием, как алканы, а также узнали о его химическом составе и методах получения. Поэтому давайте сейчас более подробно остановимся на теме нахождения алканов в природе и узнаем, как и где алканы нашли применение. |
| | | | |
| - | Обратите внимание на то, что гидропероксидная группа образуется при вторичных атомах углерода, которых больше всего в линейных, или нормальных, углеводородах.<br><br>При резком повышении давления и температуры, происходящем в конце такта сжатия, начинается разложение этих перекисных соединений с образованием большого числа свободных радикалов, которые «запускают» свободнорадикальную цепную реакцию горения раньше, чем это необходимо. Поршень еще идет вверх, а продукты горения бензина, которые уже успели образоваться в результате преждевременного поджига смеси, толкают его вниз. Это приводит к резкому уменьшению мощности двигателя, его износу.<br><br>Таким образом, основной причиной детонации является наличие перекисных соединений, способность образовывать которые максимальна у линейных углеводородов.<br><br>Наименьшей детонационной устойчивостью среди углеводородов бензиновой фракции (С5Н14 — С11Н24) обладает к-гептан. Наиболее устойчив (т. е. в наименьшей степени образует перекиси) так называемый изооктан (2,2,4-триметилпентан).<br><br>Общепринятой характеристикой детонационной устойчивости бензина является октановое число. Октановое число 92 (например, бензин А-92) означает, что данный бензин обладает теми же свойствами, что и смесь, состоящая из 92% изооктана и 8% гептана.<br><br>В заключение можно добавить, что использование высокооктанового бензина дает возможность повысить степень сжатия (давление в конце такта сжатия), что приводит к повышению мощности и КПД двигателя внутреннего сгорания.
| + | Главными источниками для получения алканов являются природный газ и нефть. Они составляют основную часть продуктов от нефтипереботки. Распространенный, в залежах осадочных пород метан, также является газовым гидратом алканов. |
| | | | |
| - | <br>1. Запишите общую формулу углеводородов гомологического ряда алканов.<br><br>2. Напишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре.<br><br>3. Что такое крекинг? Какие виды крекинга вы знаете?<br><br>4. Напишите формулы возможных продуктов крекинга гексана.<br><br>5. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б и В.<br><br>[[Image:aahim10-62.jpg]]<br><br>6. Приведите структурную формулу углеводорода С5Н12, образующего при бромировании только одно монобром-производное.<br><br>7. На полное сгорание 0,1 моль алкана неизвестного строения израсходовано 11,2 л кислорода (при н. у.). Какова структурная формула алкана?<br>
| + | Основной составляющей природного газа является метан, но в его составе присутствует и небольшая доля этана, пропана и бутана. Метан можно обнаружить в выделениях угольных пластов, болот и в попутных нефтяных газах. |
| | | | |
| - | 8. Какова структурная формула газообразного предельного углеводорода, если 11 г этого газа занимают объем 5,6 л (при н. у.)?<br><br>9. Вспомните, что вам известно о применении метана, и объясните, почему утечка бытового газа может быть обнаружена по запаху, хотя его составляющие запаха не имеют.<br><br>10*. Какие соединения могут быть получены каталитическим окислением метана в различных условиях? Напишите уравнения соответствующих реакций.<br><br>11*. Продукты полного сгорания (в избытке кислорода) 10,08 л (н. у.) смеси этана и пропана пропустили через избыток известковой воды. При этом образовалось 120 г осадка. Определите объемный состав исходной смеси.<br><br>12*. Плотность по этану смеси двух алканов равна 1,808. При бромировании этой смеси выделено только две пары изомерных монобромалканов. Суммарная масса более легких изомеров в продуктах реакции равна суммарной массе более тяжелых изомеров. Определите объемную долю более тяжелого алкана в исходной смеси.<br>
| + | Также анканы можно получить методом коксования каменного угля. В природе встречаются и так называемые твердые алканы – озокериты, которые представлены в виде залежей горного воска. Озокерит можно обнаружить в восковых покрытиях растений или их семян, а также в составе пчелиного воска. |
| | | | |
| - | <br>
| + | Промышленное выделение алканов берется из природных источников, которые к счастью пока неисчерпаемые. Их получают методом каталитического гидрирования оксидов углерода. Также метан можно получить в лабораторных условиях, используя метод нагревания ацетата натрия с твердой щелочью или гидролизом некоторых карбидов. Но и также алканы можно получить способом декарбоксилирования карбоновых кислот и при их электролизе. |
| | | | |
| - | <sub>словарик терминов [[Химия|по химии]], конспекты уроков [[Химия_10_класс|химии 10 класса]], [[Гипермаркет_знаний_-_первый_в_мире!|видео к уроку химии]]</sub> | + | <h2>Применение алканов </h2> |
| | | | |
| - | '''<u>Содержание урока</u>'''
| + | Алканы на бытовом уровне, широко применяются во многих сферах деятельности человека. Ведь очень сложно представить нашу жизнь без природного газа. И ни для кого не будет секретом, что основой природного газа является метан, из которого производят технический углерод, используемый при производстве топографических красок и шин. |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока '''
| + | Холодильник, который есть в доме у каждого, также работает благодаря соединениям алканов, применяющихся в качестве хладагентов. А полученный из метана ацетилен используют для сварки и резки металлов. |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии
| + | |
| - |
| + | |
| - | '''<u>Практика</u>'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников
| + | |
| - |
| + | |
| - | '''<u>Иллюстрации</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты
| + | |
| - |
| + | |
| - | '''<u>Дополнения</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие
| + | |
| - | '''<u></u>'''
| + | |
| - | <u>Совершенствование учебников и уроков
| + | |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми
| + | |
| - |
| + | |
| - | '''<u>Только для учителей</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения
| + | |
| - |
| + | |
| - |
| + | |
| - | '''<u>Интегрированные уроки</u>'''<u>
| + | |
| - | </u>
| + | |
| | | | |
| - | <br> | + | Теперь вы уже знаете, что алканы используются как топливо. Они присутствуют в составе бензина, керосина, солярового масла и мазута. Кроме этого, они есть и в составе смазочных масел, вазелина и парафина. |
| | + | |
| | + | В качестве растворителя и для синтеза различных полимеров, широкое применение нашел циклогексан. А в наркозе используют циклопропан. Сквалан, как высококачественное смазочное масло, является компонентом многих фармацевтических и косметических препаратов. Алканы являются сырьем, с помощью которого получают такие органические соединения, как спирт, альдегиды и кислоты. |
| | + | |
| | + | Парафин является смесью высших алканов, а так как он нетоксичен, то широко используется в пищевой промышленности. Его применяют для пропитки упаковок для молочной продукции, соков, круп и так далее, но в том числе и при изготовлении жевательных резинок. А разогретый парафин используют в медицине при парафинолечении. |
| | + | |
| | + | Помимо выше сказанного, парафином пропитаны головки спичек, для их лучшего горения, карандаши и из него изготавливают свечи. |
| | + | |
| | + | С помощью окисления парафина получают кислородосодержащие продукты, в основном органические кислоты. При смешении жидких углеводоpодов с определенным числом атомов углерода получают вазелин, который нашел широкое применение как парфюмерии и косметологии, так и в медицине. Его применяют для приготовления различных мазей, кремов и гелей. А также используют для тепловых процедур в медицине. |
| | + | |
| | + | <h2>Практические задания</h2> |
| | | | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| + | <br>1. Запишите общую формулу углеводородов гомологического ряда алканов.<br><br>2. Напишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре.<br><br>3. Что такое крекинг? Какие виды крекинга вы знаете?<br><br>4. Напишите формулы возможных продуктов крекинга гексана.<br><br>5. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б и В.<br><br>[[Image:Aahim10-62.jpg|Алканы]]<br><br>6. Приведите структурную формулу углеводорода С5Н12, образующего при бромировании только одно монобром-производное.<br><br>7. На полное сгорание 0,1 моль алкана неизвестного строения израсходовано 11,2 л кислорода (при н. у.). Какова структурная формула алкана?<br> |
| | | | |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| + | 8. Какова структурная формула газообразного предельного углеводорода, если 11 г этого газа занимают объем 5,6 л (при н. у.)?<br><br>9. Вспомните, что вам известно о применении метана, и объясните, почему утечка бытового газа может быть обнаружена по запаху, хотя его составляющие запаха не имеют.<br><br>10*. Какие соединения могут быть получены каталитическим окислением [[Метан._Молекулярна,_електронна_і_структурна_формули_метану,_поширення_у_природі|метана]] в различных условиях? Напишите уравнения соответствующих реакций.<br><br>11*. Продукты полного сгорания (в избытке кислорода) 10,08 л (н. у.) смеси этана и пропана пропустили через избыток известковой воды. При этом образовалось 120 г осадка. Определите объемный состав исходной смеси.<br><br>12*. Плотность по этану смеси двух алканов равна 1,808. При бромировании этой смеси выделено только две пары изомерных монобромалканов. Суммарная масса более легких изомеров в продуктах реакции равна суммарной массе более тяжелых изомеров. Определите объемную долю более тяжелого алкана в исходной смеси.<br> |
Текущая версия на 11:31, 11 июня 2015
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Алканы
Алканы. Определение. Общие сведения
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле СnН2n+2.
В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28' (рис. 11).
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму. В развернутом состоянии такие молекулы имеют зигзагообразную форму с углами при атомах углерода, близких к тетраэдрическому (109°280, например в молекуле н-пентана.
Особо стоит напомнить о связях, при помощи которых построены молекулы алканов. Все связи в молекулах алканов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это Þ-связи. Связи углерод—углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм. Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан.
Основы номенклатуры ИЮПАК уже обсуждались. В этой части параграфа она будет рассмотрена подробнее для алканов.
1. Выбор главной цепи
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: летил (—СН3), затем пропил (—СН2—СН2—СН3), этил (—СН2—СН3) и т. д.
Обратите внимание, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
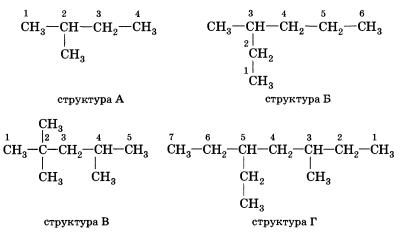
Названия веществ, структурные формулы которых приведены выше, следующие:
структура А 2-метилбутан
структура Б З-метилгексан
структура В 2,2,4-тприметилпентап
структура Г З-метил-5-этилтептан
Получение
1. Выделение углеводородов из природного сырья. Источниками предельных углеводородов, как вы уже знаете, являются нефть и природный газ.
Основной компонент природного газа — простейший углеводород метан, который используется непосредственно или подвергается переработке.
Нефть, извлеченная из земных недр, также подвергается переработке, ректификации, крекингу.
Больше всего углеводородов получают при переработке нефти и других природных источников. Но значительное количество ценных углеводородов получают искусственно, синтетическими способами.
2. Изомеризация. Наличие катализаторов изомеризации ускоряет образование углеводородов с разветвленным скелетом из линейных углеводородов:
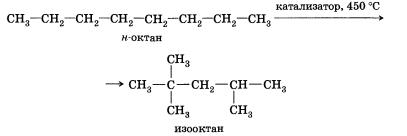
Добавление катализаторов позволяет несколько уменьшить температуру, при которой протекает реакция.
3. Гидрирование (присоединение водорода) алкенов. Как уже было сказано, в результате крекинга образуется большое количество непредельных углеводородов с двойной связью — алкенов. Уменьшить их количество можно, добавив в систему водород и катализаторы гидрирования — металлы (платина, палладий, никель):
СН3 - СН2 - СН = СН2 + Н2 -> СН3 - СН2 - СН2 - СН3
Крекинг в присутствии катализаторов гидрирования с добавлением водорода называется восстановительным крекингом. Основными его продуктами являются предельные углеводороды.
В заключение добавим, что повышение давления при крекинге (крекинг высокого давления) позволяет уменьшить количество газообразных (СН4—С4Н10) углеводородов и повысить содержание жидких углеводородов с длиной цепи 6—10 атомов углерода, которые составляют основу бензинов.
Мы рассмотрели несколько промышленных способов получения алканов, которые являются основой промышленной переработки основного углеводородного сырья — нефти.
Теперь обсудим несколько лабораторных способов получения алканов.
4. Декарбоксилирование натриевых солей карбоновых кислот.
Нагревание натриевой соли уксусной кислоты (ацетата натрия) с избытком щелочи приводит к отщеплению карбоксильной группы и образованию метана:
СН3СОNа + NаОН СН4 + Nа2С03
Если вместо ацетата натрия взять пропионат натрия, то образуется этан, из бутаноата натрия — пропан и т. д.
RСН2СОNа +NаОН -> RСН3 + Nа2С03
5. Синтез Вюрца. При взаимодействии галогеналканов с щелочным металлом натрием образуются предельные углеводороды и галогенид щелочного металла, например:
2СН3СН2Вг + 2Nа —»>СН3СН2СН2СН3 + 2NаВг
Действие щелочного металла на смесь галогенуглеводородов (например, бромэтана и бромметана) приведет к образованию смеси алканов (этана, пропана и бутана).
Реакция, на которой основан синтез Вюрца, хорошо протекает только с галогеналканами, в молекулах которых атом галогена присоединен к первичному атому углерода.
6. Гидролиз карбидов. При обработке некоторых карбидов, содержащих углерод в степени окисления -4 (например, карбида алюминия), водой образуется метан:
Аl4С3 + 12Н20 = ЗСН4 + 4Аl(ОН)3 Физические свойства
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который надо звонить по телефону 04, определяется запахом меркаптанов — серусодер-жащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С5Н12 до С15Н32 — жидкости, более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства
1. Реакции замещения. Наиболее характерными для ал-канов являются реакции свободнорадикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
СН4 + С12 —> СН3Сl + HCl
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
СН3Сl + С12 —> HCl + СН2Сl2
дихлорметан хлористый метилен
СН2Сl2 + Сl2 —> HCl + CHCl3
трихлорметан хлороформ
СНСl3 + Сl2 —> HCl + ССl4
тетрахлорметан четыреххлористый углерод
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). При пропускании алканов над катализатором (Pt, Ni, А1203, Сг2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:
СН3—СН3 —> СН2=СН2 + Н2
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнора-дикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива.
СН4 + 2O2 —> С02 + 2Н2O + 880кДж
В общем виде реакцию горения алканов можно записать следующим образом:

Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества. При нагревании до температуры 1500 °С возможно образование ацетилена.
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
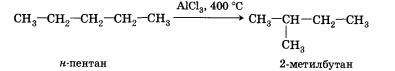
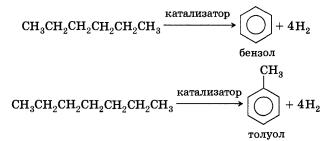
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод—углерод) связей и слабополярных С—Н (углерод—водород) связей. В них нет участков с повышенной и пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних воздействий (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, так как связи в молекулах алканов не разрываются по гетеролитическому механизму.
Наиболее характерными реакциями алканов являются реакции свободнорадикального замещения. В ходе этих реакций атом водорода замещается на атом галогена или какую-либо группу.
Кинетику и механизм свободнорадикальных цепных реакций, т. е. реакций, протекающих под действием свободных радикалов — частиц, имеющих неспаренные электроны, — изучал замечательный русский химик Н. Н. Семенов. Именно за эти исследования ему была присуждена Нобелевская премия по химии.
Обычно механизм реакции свободнорадикального замещения представляют тремя основными стадиями:
1. Инициирование (зарождение цепи, образование свободных радикалов под действием источника энергии — ультрафиолетового света, нагревания).
2. Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые радикалы и новые молекулы).
3. Обрыв цепи (объединение свободных радикалов в неактивные молекулы (рекомбинация), «гибель» радикалов, прекращение развития цепи реакций).
Научные исследования Н.Н. Семенова
Семенов Николай Николаевич
(1896 - 1986)

Советский физик и физикохимик, академик. Лауреат Нобелевской премии (1956). Научные исследования относятся к учению о химических процессах, катализе, цепных реакциях, теории теплового взрыва и горении газовых смесей.
Рассмотрим этот механизм на примере реакции хлорирования метана:
СН4 + Сl2 —> СН3Сl + НСl
Инициирование цепи происходит в результате того, что под действием ультрафиолетового облучения или при нагревании происходит гомолитический разрыв связи Сl—Сl и молекула хлора распадается на атомы:
Сl: Сl —> Сl· + Сl·
Образовавшиеся свободные радикалы атакуют молекулы метана, отрывая у них атом водорода:
СН4 + Сl· —> СН3· + НСl
и превращая в радикалы СН3·, которые, в свою очередь, сталкиваясь с молекулами хлора, разрушают их с образованием новых радикалов:
СН3· + Сl2 —> СН3Сl + Сl· и т. д.
Происходит развитие цепи.
Наряду с образованием радикалов происходит их «гибель» в результате процесса рекомбинации — образования неактивной молекулы из двух радикалов:
СН3· + Сl· —> СН3Сl
Сl· + Сl· —> Сl2
СН3· + СН3· —> СН3—СН3
Интересно отметить, что при рекомбинации выделяется ровно столько энергии, сколько необходимо для разрушения только что образовавшейся связи. В связи с этим рекомбинация возможна только в том случае, если в соударении двух радикалов участвует третья частица (другая молекула, стенка реакционного сосуда), которая забирает на себя избыток энергии. Это дает возможность регулировать и даже останавливать свободнорадикальные цепные реакции.
Обратите внимание на последний пример реакции рекомбинации — образование молекулы этана. Этот пример показывает, что реакция с участием органических соединений представляет собой достаточно сложный процесс, в результате которого, наряду с основным продуктом реакции, очень часто образуются побочные продукты, что приводит к необходимости разрабатывать сложные и дорогостоящие методики очистки и выделения целевых веществ.
В реакционной смеси, полученной при хлорировании метана, наряду с хлорметаном (СН3Сl) и хлороводородом, будут содержаться: дихлорметан (СН2Сl2), трихлорметан (СНСl3), тетрахлорметан (ССl4), этан и продукты его хлорирования.
Теперь попытаемся рассмотреть реакцию галогенирования (например, бромирования) более сложного органического соединения — пропана.
Если в случае хлорирования метана возможно только одно моно-хлорпроизводное, то в этой реакции может образоваться уже два монобромпроизводных:
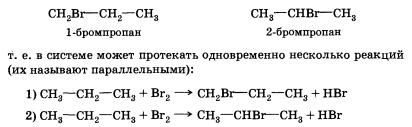
Видно, что в первом случае происходит замещение атома водорода при первичном атоме углерода, а во втором — при вторичном. Одинаковы ли скорости этих реакций? Оказывается, что в конечной смеси преобладает продукт замещения атома водорода, который находится при вторичном углероде, т. е. 2-бромпропан (СН3—СНВг—СН3). Давайте попытаемся объяснить это.
Для того чтобы это сделать, нам придется воспользоваться представлением об устойчивости промежуточных частиц. Вы обратили внимание, что при описании механизма реакции хлорирования метана мы упомянули радикал метил — СН3·? Этот радикал является промежуточной частицей между метаном СН4 и хлорметаном СН3Сl. Промежуточной частицей между пропаном и 1-бромпропаном является радикал с неспаренным электроном при первичном углероде, а между пропаном и 2-бромпропаном — при вторичном.
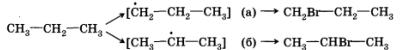
Радикал с неспаренным электроном при вторичном атоме углерода (б) является более устойчивым по сравнению со свободным радикалом с неспаренным электроном при первичном атоме углерода (а). Он и образуется в большем количестве. По этой причине основным продуктом реакции бромирования пропана является 2-бром-пропан — соединение, образование которого протекает через более устойчивую промежуточную частицу.
Приведем несколько примеров свободнорадикальных реакций:
Реакция нитрования (реакция Коновалова)
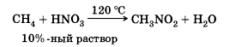
Реакция применяется для получения нитросоединений — растворителей, исходных веществ для многих синтезов.
Каталитическое окисление алканов кислородом
Эти реакции являются основой важнейших промышленных процессов получения альдегидов, кетонов, спиртов непосредственно из предельных углеводородов, например:
СН4 + [О] —> СН3ОН
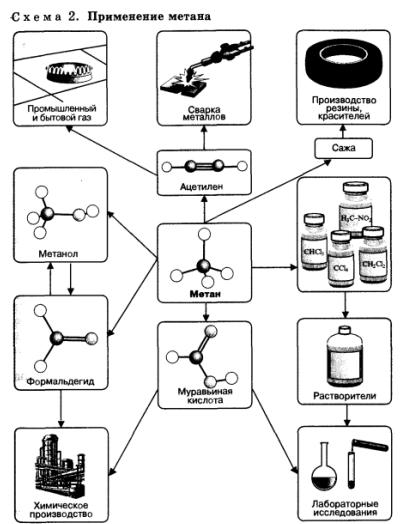
Применение
Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.
Соединения, полученные из метана, самого дешевого углеводородного сырья, применяют для получения множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений.
Углеводороды более высококипящих фракций нефти используются как горючее для дизельных, турбореактивных двигателей, как основа смазочных масел, как сырье для производства синтетических жиров и т. д.
Приведем несколько промышленно значимых реакций, протекающих с участием метана. Метан используют для получения хлороформа, нитрометана, кислородсодержащих производных. Спирты, альдегиды, карбоновые кислоты могут образовываться при непосредственном взаимодействии алканов с кислородом в зависимости от условий проведения реакций (катализатора, температуры, давления):

Как вы уже знаете, углеводороды состава от С5Н12 до С11Н24 входят в бензиновую фракцию нефти и применяются в основном как горючее для двигателей внутреннего сгорания. Известно, что наиболее ценными компонентами бензина являются изомерные углеводороды, так как они обладают максимальной детонационной устойчивостью.
Углеводороды при контакте с кислородом воздуха медленно образуют с ним соединения — перекиси. Это медленно протекающая свободнорадикальная реакция, инициатором которой является молекула кислорода:
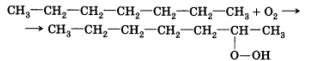
Обратите внимание на то, что гидропероксидная группа образуется при вторичных атомах углерода, которых больше всего в линейных, или нормальных, углеводородах.
При резком повышении давления и температуры, происходящем в конце такта сжатия, начинается разложение этих перекисных соединений с образованием большого числа свободных радикалов, которые «запускают» свободнорадикальную цепную реакцию горения раньше, чем это необходимо. Поршень еще идет вверх, а продукты горения бензина, которые уже успели образоваться в результате преждевременного поджига смеси, толкают его вниз. Это приводит к резкому уменьшению мощности двигателя, его износу.
Таким образом, основной причиной детонации является наличие перекисных соединений, способность образовывать которые максимальна у линейных углеводородов.
Наименьшей детонационной устойчивостью среди углеводородов бензиновой фракции (С5Н14 — С11Н24) обладает к-гептан. Наиболее устойчив (т. е. в наименьшей степени образует перекиси) так называемый изооктан (2,2,4-триметилпентан).
Общепринятой характеристикой детонационной устойчивости бензина является октановое число. Октановое число 92 (например, бензин А-92) означает, что данный бензин обладает теми же свойствами, что и смесь, состоящая из 92% изооктана и 8% гептана.
В заключение можно добавить, что использование высокооктанового бензина дает возможность повысить степень сжатия (давление в конце такта сжатия), что приводит к повышению мощности и КПД двигателя внутреннего сгорания.
Нахождение в природе и получение
На сегодняшнем уроке вы познакомились с таким понятием, как алканы, а также узнали о его химическом составе и методах получения. Поэтому давайте сейчас более подробно остановимся на теме нахождения алканов в природе и узнаем, как и где алканы нашли применение.
Главными источниками для получения алканов являются природный газ и нефть. Они составляют основную часть продуктов от нефтипереботки. Распространенный, в залежах осадочных пород метан, также является газовым гидратом алканов.
Основной составляющей природного газа является метан, но в его составе присутствует и небольшая доля этана, пропана и бутана. Метан можно обнаружить в выделениях угольных пластов, болот и в попутных нефтяных газах.
Также анканы можно получить методом коксования каменного угля. В природе встречаются и так называемые твердые алканы – озокериты, которые представлены в виде залежей горного воска. Озокерит можно обнаружить в восковых покрытиях растений или их семян, а также в составе пчелиного воска.
Промышленное выделение алканов берется из природных источников, которые к счастью пока неисчерпаемые. Их получают методом каталитического гидрирования оксидов углерода. Также метан можно получить в лабораторных условиях, используя метод нагревания ацетата натрия с твердой щелочью или гидролизом некоторых карбидов. Но и также алканы можно получить способом декарбоксилирования карбоновых кислот и при их электролизе.
Применение алканов
Алканы на бытовом уровне, широко применяются во многих сферах деятельности человека. Ведь очень сложно представить нашу жизнь без природного газа. И ни для кого не будет секретом, что основой природного газа является метан, из которого производят технический углерод, используемый при производстве топографических красок и шин.
Холодильник, который есть в доме у каждого, также работает благодаря соединениям алканов, применяющихся в качестве хладагентов. А полученный из метана ацетилен используют для сварки и резки металлов.
Теперь вы уже знаете, что алканы используются как топливо. Они присутствуют в составе бензина, керосина, солярового масла и мазута. Кроме этого, они есть и в составе смазочных масел, вазелина и парафина.
В качестве растворителя и для синтеза различных полимеров, широкое применение нашел циклогексан. А в наркозе используют циклопропан. Сквалан, как высококачественное смазочное масло, является компонентом многих фармацевтических и косметических препаратов. Алканы являются сырьем, с помощью которого получают такие органические соединения, как спирт, альдегиды и кислоты.
Парафин является смесью высших алканов, а так как он нетоксичен, то широко используется в пищевой промышленности. Его применяют для пропитки упаковок для молочной продукции, соков, круп и так далее, но в том числе и при изготовлении жевательных резинок. А разогретый парафин используют в медицине при парафинолечении.
Помимо выше сказанного, парафином пропитаны головки спичек, для их лучшего горения, карандаши и из него изготавливают свечи.
С помощью окисления парафина получают кислородосодержащие продукты, в основном органические кислоты. При смешении жидких углеводоpодов с определенным числом атомов углерода получают вазелин, который нашел широкое применение как парфюмерии и косметологии, так и в медицине. Его применяют для приготовления различных мазей, кремов и гелей. А также используют для тепловых процедур в медицине.
Практические задания
1. Запишите общую формулу углеводородов гомологического ряда алканов.
2. Напишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре.
3. Что такое крекинг? Какие виды крекинга вы знаете?
4. Напишите формулы возможных продуктов крекинга гексана.
5. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б и В.
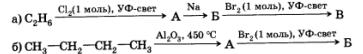
6. Приведите структурную формулу углеводорода С5Н12, образующего при бромировании только одно монобром-производное.
7. На полное сгорание 0,1 моль алкана неизвестного строения израсходовано 11,2 л кислорода (при н. у.). Какова структурная формула алкана?
8. Какова структурная формула газообразного предельного углеводорода, если 11 г этого газа занимают объем 5,6 л (при н. у.)?
9. Вспомните, что вам известно о применении метана, и объясните, почему утечка бытового газа может быть обнаружена по запаху, хотя его составляющие запаха не имеют.
10*. Какие соединения могут быть получены каталитическим окислением метана в различных условиях? Напишите уравнения соответствующих реакций.
11*. Продукты полного сгорания (в избытке кислорода) 10,08 л (н. у.) смеси этана и пропана пропустили через избыток известковой воды. При этом образовалось 120 г осадка. Определите объемный состав исходной смеси.
12*. Плотность по этану смеси двух алканов равна 1,808. При бромировании этой смеси выделено только две пары изомерных монобромалканов. Суммарная масса более легких изомеров в продуктах реакции равна суммарной массе более тяжелых изомеров. Определите объемную долю более тяжелого алкана в исходной смеси.
|